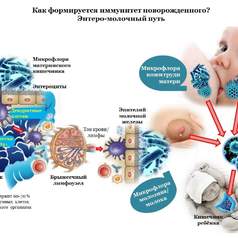
Биоценоз кишечника, в состав которого входит более 400 видов микроорганизмов, превышающих общей численностью число клеток макроорганизма-хозяина, выполняет многочисленные функции, причем метаболизм бактерий в норме тесно связан с метаболизмом человека, и наоборот.
Неразрывная метаболическая связь кишечной микрофлоры и ее хозяина определяет существенные последствия нарушения микробиоценоза желудочно-кишечного тракта (ЖКТ).
К важнейшим функциям бактерий кишечника относятся обеспечение антиинфекционной защиты, стимуляция иммунных функций макроорганизма, индукция иммунологической толерантности, обеспечение питания толстой кишки, а также всасывания минералов и воды, синтез витаминов группы В и К, регуляция липидного и азотистого обмена, регуляция кишечной моторики.
Антиинфекционная защита обеспечивается как собственными силами бактерий кишечника, так и стимуляцией иммунной системы, что будет рассмотрено далее. Антагонизм представителей нормальной микрофлоры по отношению к другим микробам проявляется в конкуренции за субстраты для роста, за места фиксации, стимуляции перистальтики, в создании неблагоприятной окружающей среды (в том числе модификации/деконъюгации желчных кислот), синтезе антибиотикоподобных веществ [1].
Взаимодействие нормальной кишечной микрофлоры с иммунной системой многогранно, и одной из граней этих взаимоотношений является обеспечение иммунологической толерантности.
Компоненты протеогликанов, покрывающих снаружи бактериальную клетку (в первую очередь это относится к лактобактериям), возможно, высвобождающиеся под воздействием лизоцима, вырабатывающегося клетками эпителия кишечника, стимулируют антигенпрезентирующие клетки (мононуклеарные клетки, эпителиоциты), которые отвечают продукцией интерлейкина-10 и трансформирующего фактора роста-B.
Перечисленные цитокины определяют дифференцировку "нулевых" Т-хелперов по путям формирования Т-хелперов первого и третьего типов, обеспечивающих развитие клеточного антибактериального иммунологического ответа и иммунологической толерантности, но не гуморального ответа с образованием антител, за который ответственны Т-хелперы второго типа.
Таким образом, нормальная микрофлора ЖКТ выполняет "антиаллергическую" функцию. Более того, нарушения кишечного микробиоценоза часто проявляются нарастанием аллергических реакций. Нарушение становления кишечной микрофлоры в первые месяцы жизни, в частности в случае искусственного вскармливания смесями без пребиотических компонентов, значительно повышает риск аллергических реакций.
В этом случае развитие аллергии связано не только с повышением антигенной нагрузки (белки коровьего молока), но также и с недостаточностью функций бактерий кишечника [2].
Нормальная кишечная микрофлора в процессе своей жизнедеятельности и утилизации углеводов (ди-, олиго- и полисахариды) синтезирует короткоцепочечные жирные кислоты (КЦЖК), которые определяют снижение кишечного рН, принимают участие в регуляции моторики.
Кроме того, бутират необходим для эпителия толстой кишки в качестве энергетического субстрата, он является регулятором апоптоза, процессов дифференцировки и пролиферации колоноцитов, в связи с чем с ним и, соответственно, с микрофлорой связывают антиканцерогенные эффекты. Бутират принимает также непосредственное участие в процессах всасывания воды, натрия, хлора, кальция и магния.
Нарушение состава микрофлоры толстой кишки приводит к нарушению функции эпителиальных клеток, в том числе всасывания перечисленных воды, электролитов и минералов, способствует канцерогенезу, а также нарушает моторику, которая может как ускоряться, так и замедляться вплоть до формирования хронических запоров [3].
Важной метаболической функцией кишечной микрофлоры является синтез витаминов группы В и витамина К. Микроорганизмы тонкой кишки синтезируют витамин К2 – группу соединений, называющихся менахинонами – синтезирующихся микрофлорой в тонкой кишке. Синтез менахинонов стимулируется при недостатке в питании филохинона (витамин К1) растительного происхождения.
Прием антибиотиков, приводящий к подавлению тонкокишечной микрофлоры, может приводить к развитию антибиотикиндуцированного геморрагического диатеза (гипопротромбинемия) [4]. Интересно, что синтез витамина К2 может повышаться при избыточном росте тонкокишечной микрофлоры, например на фоне приема препаратов, снижающих желудочную секрецию, в том числе блокаторов протонного насоса [5].
Таким образом, нарушение состояния нормальной микрофлоры приводит к существенным метаболическим и иммунологическим сдвигам в организме-хозяине. Одним из факторов, способствующих развитию указанных нарушений, может быть прием антибиотиков с развитием так называемого антибиотикассоциированного дисбактериоза кишечника (ААДК).
В зарубежной литературе часто используется термин "антибиотикассоциированная диарея (antibiotic associated diarrhea)", который можно считать синонимом термина "антибиотикоссоциированный дисбактериоз кишечника".
Так как в случаях ААДК практически всегда эндоскопически и гистологически выявляются признаки колита, в литературе также часто встречается термин "антибиотикоссоциированный колит". Частота ААДК, по данным различных авторов, колеблется от 5 до 39%. Факторами риска считаются возраст пациента младше 6 лет и старше 65 лет, а также сопутствующие заболевания органов пищеварения и снижение функции иммунной системы.
Воздействие различных антибиотиков на кишечную микрофлору различается по характеру и интенсивности воздействия. Так, ампициллин существенно подавляет рост как аэробных, так и анаэробных микроорганизмов, тогда как амоксициллин в минимальной степени подавляет нормальную микрофлору, но способствует некоторому увеличению популяции представителей Enterobacteriacaea.
При этом современные пенициллины не способствуют размножению грибов и С. difficile. Перорально принятые цефподоксим, цефпрозил и цефтибутен способствуют росту численности рода Enterobacteriacaea в кишечнике, тогда как цефаклор и цефрадин практически не оказывают влияния на кишечную микрофлору.
Применение цефиксима ведет к значительному снижению анаэробных микроорганизмов. Большинство цефалоспоринов способствует росту численности энтерококков и С. difficile. Фторхинолоны в значительной степени угнетают рост микробов рода Enterobacteriacaea и в меньшей степени – энтерококков и анаэробных микроорганизмов, не способствуя при этом росту грибов и С. difficile [6].
Наиболее тяжелым и угрожающим жизни состоянием является колит, ассоциированный с С. difficile и его крайнее проявление – псевдомембранозный колит. Эти заболевания связаны с избыточным размножением в кишечнике С. difficile, который в норме выявляется при бактериологическом исследовании у 1–3% здоровых лиц, но более чем у 20% пациентов, получающих антибактериальную терапию.
У отдельных больных на фоне угнетения нормальной флоры происходит лавинообразный рост популяции С. difficile с изменением его токсигенных свойств: повышением синтеза энтеротоксина А и цитотоксина В. Следствием этого патологического процесса становится тяжелое поражением слизистой оболочки толстой кишки.
Чаще всего С. difficile-ассоциированный колит развивается при применении клиндамицина или линкомицина, полусинтетических пенициллинов, реже – цефалоспоринов с широким спектром антибактериального действия. Псевдомембранозный колит является тяжелым, жизнеугрожающим заболеванием, летальность при котором достигает 30% [7–9].
Типичными симптомами ААДК являются учащение и разжижение стула, появление в нем патологических примесей в виде зелени, слизи, реже, при тяжелом поражении – крови. Общее состояние обычно страдает мало и определяется основным патологическим процессом, который стал причиной назначения антибиотиков, однако в случае развития С. difficile-ассоциированного колита состояние значительно ухудшается.
Псевдомембранозный колит характеризуется сильными болями в животе, подъемом температуры до 40°С, частым (10–20 раз в сутки) жидким стулом с примесью слизи и крови, признаками тяжелого эндотоксикоза. В крови выявляют лейкоцитоз и увеличение СОЭ. В толстой кишке обнаруживаются гиперемия слизистой оболочки и фибринозные пленки, образовавшиеся на участках некроза, в виде бледных серовато-желтых бляшек размером 0,5–2 см в диаметре на слегка приподнятом основании.
Гистологически выявляются участки некроза слизистой оболочки толстой кишки, отек подслизистого слоя, круглоклеточная инфильтрация собственной пластинки и фокальные экстравазаты эритроцитов. Наиболее доступным диагностическим тестом при псевдомембранозном колите является определение в фекалиях токсина А С. difficile методом латекс-агглютинации.
Лечение ААДК желательно начинать с отмены или смены антибиотика. В качестве патогенетической терапии назначают средства, способствующие восстановлению кишечной микрофлоры. В настоящее время можно выделить три основные группы таких средств. К первой группе относятся пребиотики – нутриенты, являющиеся энергетическим субстратом для роста и развития нормальной кишечной микрофлоры.
Недостаток пребиотиков в питании может быть сам по себе причиной дисбактериоза кишечника, например может наблюдаться у детей первого года жизни, находящихся на искусственном вскармливании. В женском молоке в качестве пребиотических факторов содержатся дисахарид лактоза и различные олигосахариды.
Последние не расщепляются ферментативными системами кишечника, достигают толстой кишки, где утилизируются микрофлорой. В связи с этим при невозможности естественного вскармливании рекомендуется применение смесей, содержащих пребиотики, в частности смеси галакто- и фруктоолигосахаридов.
Недостаток пребиотиков может сказаться и в более старшем возрасте: с недостатком в питании пищевых волокон, в частности, связывают не только высокую частоту функциональных запоров у взрослых жителей индустриально развитых стран, но также повышение частоты рака толстой кишки. Таким образом, рациональное питание с включением достаточного количества пребиотических компонентов является необходимым условием нормального состояния кишечной микрофлоры.
Второй группой средств коррекции состава кишечного микробиоценоза являются пробиотики – живые микроорганизмы в составе пищевых продуктов (в первую очередь кисломолочных), лекарственных препаратов или биологически активных добавок, которые, приживаясь на некоторое время в кишечнике, различными путями (в том числе продуцируя свои метаболиты и взаимодействуя с иммунной системой макроорганизма) обеспечивают восстановление нормального микробиоценоза.
Достоверно доказанным действием с точки зрения пробиотического эффекта обладают следующие микроорганизмы: Lactobacillus acidophilus, Lactobacillus GG, Lactobacillus fermentum, Strepto (Entero) coccus faecium SF68, S. termophilus и B. bifidum. На основе этих бактерий в настоящее время выпускается достаточно большое число лекарственных препаратов (бифидум-бактерин, линекс, бифиформ и др.), в которых применяются антибиотикоустойчивые штаммы перечисленных микроорганизмов, а для защиты от кислоты желудка бактерии заключены в капсулу. Пробиотики издавна используются для лечения ААДК.
К третьей группе средств устранения дисбактериоза являются сами метаболиты, продуцируемые микроорганизмами, нормальными обитателями кишечника человека. Лекарственным препаратом такого типа является хилак форте. Хилак форте представляет собой стерильный концентрат продуктов жизнедеятельности грамположительных и грамотрицательных микроорганизмов – симбионтов тонкой и толстой кишки.
Продуцентами метаболитов при этом являются Lactobacillus helveticus, Lactobacillus acidophilus и Escherichia coli. Препарат характеризуется кислото- и антибиотикоустойчивостью. Препарат выпускается в жидком виде и дозируется каплями. Детям назначают его по 15–30 капель (в зависимости от возраста) 3 раза в день. Хилак форте зарекомендовал себя в качестве эффективного средства коррекции дисбактериоза кишечника у детей и взрослых, в том числе связанного с приемом антибиотиков.
Хотя теоретически для коррекции дисбактериоза кишечника обосновано одновременное применение средств всех трех групп, реально препараты второй и третьей групп (пробиотики и метаболиты) могут применяться как совместно, так и раздельно, что определяется индивидуально с учетом особенностей пациента и характера течения патологического процесса.
Лечение псевдомембранозного колита начинается с отмены проводимой ранее антибактериальной терапии (клиндамицин, ампициллин, цефалоспорины, аминогликозиды, линкомицин и др.) и назначения препаратов, способных к эрадикации С. difficile в кишечнике (метронидазол или ванкомицин в сочетании с энтеросорбентами). Также проводят коррекцию водно-электролитных нарушений и симптоматическую терапию.
По мере восстановления состояния кишечника в терапию включают биопрепараты для окончательного восстановления микробиоценоза толстой кишки.
Профилактика ААДК заключается в рациональном использовании антибиотиков, а при необходимости их применения – назначении средств для коррекции состава кишечной микрофлоры на фоне приема препаратов и после окончания курса антибиотикотерапии.
Литература
1. Rolfe RD. Interactions among microorganisms of the indigenous intestinal flora and their influence on the host. Rev Infect Dis 1984; 6 (Suppl. 1): S73–79.
2. Crane J. Pro and anti: the biotics of allergic disease. Thorax 2002; 57 (Suppl. II): P. ii40–ii46.
3. Jenkins DJA, Kendall CWC, Vuksan V. Inulin, Oligofructose and Intestinal Function. J Nutr 1999; 129: 1431S–3S.
4. Paiva SAR, Sepe TE, Booth SL, Camilo ME, O’Brien ME, Davidson KW, Sadowski JA, Russell RM. Interaction between vitamin K nutriture and bacterial overgrowth in hypochlorhydria induced by omeprazole. Am J Clin Nutr 1998; 68: 699–704.
5. Paiva SA, Sepe TE, Booth SL et al. Interaction between vitamin K nutriture and bacterial overgrowth in hypochlorhydria induced by omeprazole. Am J Clin Nutr 1998; 68 (3): 699–704.
6. Edlund C, Nord CE. Effect on the human normal microflora of oral antibiotics for treatment of urinary tract infection. J Antimicrob Chemoter 2000; 46 (Suppl. S1): P. 41.
7. Ерюхин И.А., Шляпников С.А., Лебедев В.Ф., Иванов Г.А.. Псевдомембранозный колит и "кишечный сепсис" – следствие дисбактериоза, вызванного антибиотиками. Вестн. хирургии им. И.И.Грекова. 1997; 156 (2): 108–11.
8. Sullivan A, Edlund C, Nord CE. Effect of antimicrobial agents on the ecological balance of human microflora. Lancet Infect Dis 2001; 1 (2): 101–14.
9. McFarland LV. Risk factor for antibiotic-associated diarrhea. Ann Med Intern (Paris) 1998; 149 (5): 261–6.