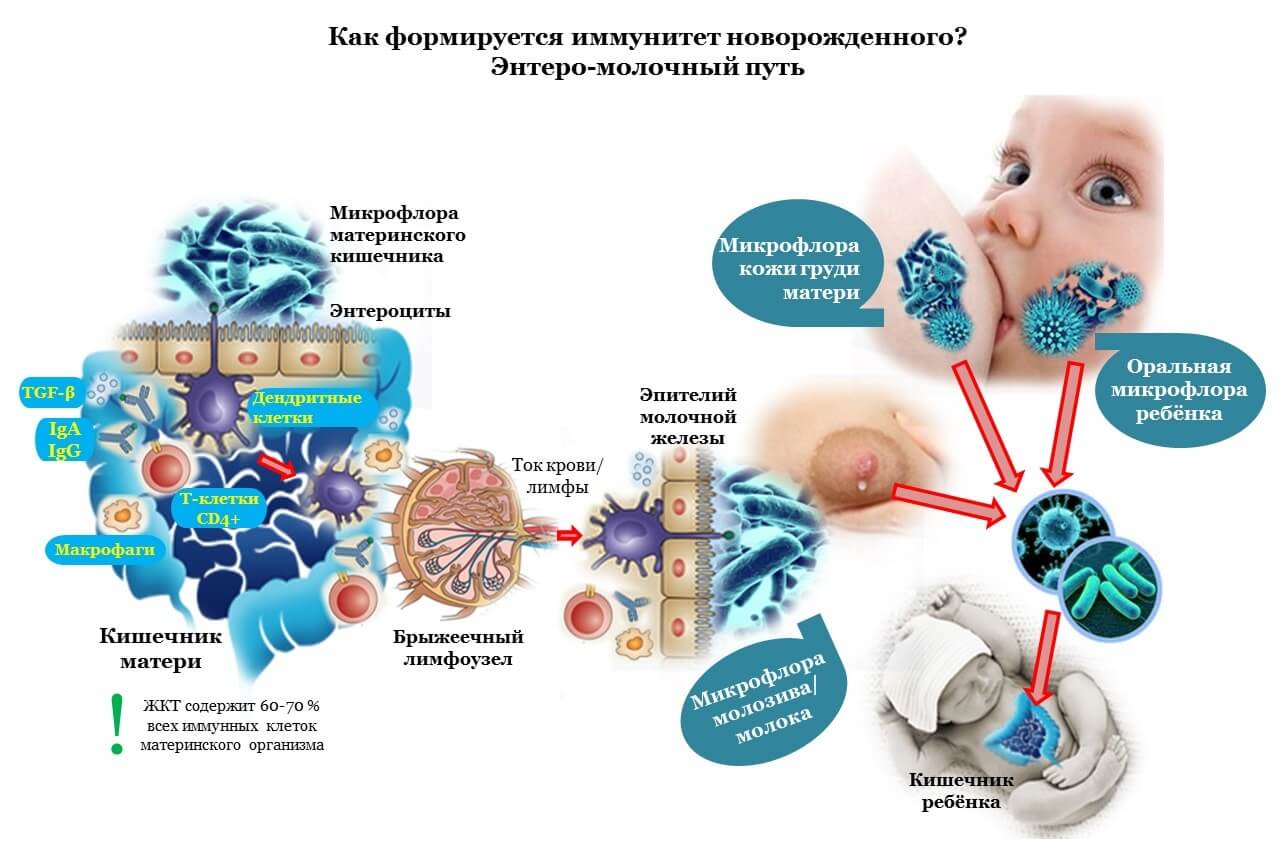
Становление микробиоценоза у новорожденного начинается уже с первых минут жизни, когда организм ребенка колонизируется бифидо-, лактобактериями матери, а также условно патогенной микрофлорой матери, окружающей среды, медицинского персонала.
Физиологическая подготовка организма беременной женщины к родам имеет такой важный компонент как колонизация кожи грудных желез, особенно околососковых областей, кишечника, родовых путей бифидо- и лактобактериями. У здоровых женщин микрофлора влагалища представлена, в основном, ацидофильными лактобациллами, которые предупреждают развитие патогенных микроорганизмов. Данный природный механизм направлен на повышение колонизационной резистентности организма новорожденного с целью заселения ребенка с первых минут жизни физиологической микрофлорой, осуществляющей защитную, иммунную, витаминообразующую и другие жизненно важные функции организма. .
Проблема микробиологического здоровья новорожденных и формирования оптимального микробиоценоза имеет непосредственную связь с источниками нормальной микрофлоры. Таким источником для новорожденного должна быть мать, при условии раннего кожного контакта матери и новорожденного (выкладывание ребенка на живот матери сразу после рождения), раннего прикладывания к груди в первые 30 минут, последующего кожного контакта матери и ребенка в течение 2 часов после рождения, когда ребенок находится на груди матери) и последующего совместного пребывания матери и новорожденного на всех этапах оказания медицинской помощи. .
В проведенных нами исследованиях совместно с лабораторией общей микробиологии Института эпидемиологии и инфекционных болезней им. Л.В. Громашевского АМН Украины еще в 1985-1990гг. показано, что даже при физиологическом течении беременности и родов новорожденные уже внутриутробно (преимущественно интранатально при прохождении через родовые пути) колонизируются условно патогенными грамотрицательными энтеробактериями, стафилококками, что в дальнейшем приводит к нарушению физиологического становления микробиоценоза. Так, классическая асептическая фаза (1-ая фаза) формирования микробиоценоза была установлена только у 24,5% здоровых новорожденных в первые минуты жизни (Е.Е. Шунько,1989). Переходной етап (транзиторного дисбактериоза) формирования микробиоценоза, который по классической схеме должен завершаться к 6-7-ому дню жизни, в наших наблюдениях продолжался в течение первого месяца жизни и только у 50-60% детей был близок к физиологическому в фазе стабилизации биоценоза. .
Работами О.П.Сельниковой (1992), Л.И.Чернышовой (1988) была показана важная роль условно патогенных энтеробактерий в формировании патологической колонизации новорожденных как здоровых, так и групп перинатального риска. Так, в колонизации новорожденных первых часов и дней жизни важная роль принадлежала представителям бактерий семейства Enterobacteriaceae: Klebsiella pneumoniae, Enterobacter aerogenes, E.coli, Proteus spp. Л.И.Чернышовой (1988) разработан метод направленной микробной колонизации новорожденных групп перинатального риска с использованием культуры ацидофильной палочки. .
В исследованиях последних лет Е.И.Полищук (1999), Л.В.Авдеевой (1999) установлена ведущая роль Staphylococcus epidermidis в колонизации как здоровых новорожденных, так и детей с перинатальной патологией. .
Показано, что даже здоровые новорожденные при совместном (отсроченном) пребывании с матерью в родильном доме колонизируются штаммами условно патогенных энтеробактерий и стафилококков, устойчивых к антибиотикам, что с наибольшей вероятностью говорит об их госпитальном происхождении. Все это способствует нарушению формирования микробиоценоза новорожденных и детей раннего возраста, что в последующем повышает риск развития острых и хронических заболеваний органов желудочно-кишечного тракта, органов дыхания. Дисбиоценоз организма повышает риск развития аллергических заболеваний, иммунных нарушений. .
2. Факторы риска нарушений формирования микробиоценоза у новорожденных.
Повышение удельного веса беременных с высоким перинатальным риском, в том числе с острыми и хроническими урогенитальными инфекциями, угрозой прерывания беременности, отягощенным акушерcко-гинекологическим анамнезом, экстрагенитальной патологией обусловливает феномен внутриамниальной и интранатальной колонизации плода и новорожденного вирусами, бактериями, грибами. При этом микроэкологический имидж плода и новорожденного, колонизированного вирусами, бактериями, грибами и другими микроорганизмами необходимо рассматривать как фактор высокого септического риска, а также риска развития патологических состояний у новорожденного, когда ребенок не усваивает энтеральное питание, имеет клинические проявления так называемого некротического энтероколита, диареи, потери массы тела, интоксикации, метаболических расстройств. .
В такой ситуации врачи неонатологи и педиатры часто идут по традиционному пути исследования кала на дисбактериоз с последующим назначением антибиотиков (что практически недопустимо в случаях дисбиоценоза у детей раннего возраста). .
Наш клинический опыт, а также результаты клинико-микробиологического мониторинга проводимого у новорожденных, позволил выделить группы риска по нарушению формирования перинатального микробиоценоза плода и новорожденного: .
Факторы риска нарушений перинатального микробиоценоза у плода и новорожденного
- Пренатальные факторы риска:
- отягощенный акушерско-гинекологический анамнез:
- невынашивание
- бесплодие
- мертворождение
- смерть предыдущих детей в неонатальном периоде
- осложненное течение беременности
- угроза прерывания беременности
- острые и хронические урогенитальные инфекции:
- генитальный герпес
- хламидийная, уреаплазменная инфекция
- бактериальный вагиноз
- генитальное носительство стрептококка
- кандидоз половых органов
- экстрагенитальная патология
- сахарный диабет матери
- острый и хронический пиелонефрит
- острые и хронические заболевания желудочно-кишечного тракта
- гестоз
- хроническая фетоплацентарная недостаточность
- отягощенный акушерско-гинекологический анамнез:
- Интранатальные факторы риска
- длительность безводного периода более 6 часов (околоплодные воды через 6 часов утрачивают свои бактерицидные свойства)
- материнская инфекция в родах
- хориоамнионит
- эндометрит
- острый и хронический пиелонефрит
- инфекции родовых путей (носительство стрептококков, кандидоз, генитальный герпес и др.)
- острая интранатальная гипоксия плода и асфиксия новорожденного
- кесарево сечение
- акушерские вмешательства в родах: частые влагалищные исследования, наложение акушерских щипцов и др.
- медикаментозные роды
- Постнаталъные факторы риска:
- преждевременное рождение
- оценка состояния при рождении 5 баллов и менее
- перинатальная асфиксия
- вскармливание молочными смесями
- долактационное кормление молочными смесями
- нахождение ребенка отдельно от матери
- интенсивный неонатальный уход - интенсивная терапия
- антибактериальная терапия
- искусственная вентиляция легких
- парентеральное питание
- катетеризация сосудов
- внутриутробные инфекции
- перинатальные инфекции
- сепсис
Применение пробиотика Симбитер в раннем неонатальном периоде.
Цель - оптимизация формирования физиологического микробиоценоза у новорожденных, направленная на профилактику неонатальной заболеваемости, предупреждение формирования нозокомиальных штаммов бактерий и нозокомиальных инфекций в отделениях новорожденных, формирование здоровья детей раннего возраста.
Тактика врача-неонатолога, педиатра: направленная колонизация верхних дыхательных путей, желудочно-кишечного тракта пробиотиком Симбитер, содержащим живые (активные) штаммы бифидо-, лакто-, пропионовокислых и др.бактерий.
У новорожденных групп перинатального риска Симбитер начинают вводить во время первичного туалета новорожденного после отсасывания слизи из носа и полости рта до начала активного заселения верхних дыхательных путей микрофлорой
Проводят обработку ротовой полости с помощью стерильной палочки с ватой, пропитанной жидким препаратом Симбитер. С помощью индивидуальной стерильной пипетки Симбитер закапывают в носовые ходы, после чего идеальным является раннее прикладывание ребенка к груди, чтобы ребенок получил первые капли молозива и материнскую микрофлору.
Преимуществом пробиотика Симбитер является то, что он изготавливается в активной нелиофилизированной "живой" форме, благодаря чему проявляет пробиотический эффект сразу после перорального введения в организм, начиная свое действие с полости эта. Эта особенность пробиотического действия Симбитера позволила рекомендовать его для обработки полости рта и носа новорожденных детей.