Как поддерживать нормальную микрофлору.
Диэтические нюансы.
Гомеостаз пристеночной микрофлоры кишечника предполагает ее постоянство по отношению к каждодневным диэтическим нюансам. Однако, можно ожидать заметные сдвиги в составе микроорганизмов кишечника при длительных диэтических ориентациях: у вегетарианцев или, напротив, у жителей крайнего севера, имеющих ограничения в растительной пищи.
Можно предполагать сдвиги гомеостаза в связи с географическими, расовыми, религиозными или национальными устойчивыми особенностями питания. Например, у жителей города Лунда (Швеция) больше актиномицетов в кишечнике по сравнению с жителями Москвы.
С другой стороны, трудно представить кратковременную (в течение суток, недели) диэтическую зависимость состава микрофлоры кишечника. По существу назначения этот орган должен быть стабильным (гомеостатичным) поскольку определяет композицию множества химических веществ, поступающих в организм хозяина.
Эти вещества, в свою очередь, определяют качество физиологических процессов всех других органах и тканях. Они также гомеостатичны, что требует постоянства состава и концентрации необходимых для осуществления клеточных циклов веществ с одной стороны и минимума их ингибиторов с другой.
Логично ожидать, что любые существенные отклонения провоцируют патологические последствия. Но этого не происходит из-за того, что в обед вы ели рыбное или овощное, а на ужин мясное или творожное.
Объяснение тому не трудно получить, если вспомнить, что на самом деле в кишечник попадает не сами овощи или мясо а продукты их первичной деградации в кишечнике при действии ферментов в кислой среде. То есть упрощенно говоря – белки жиры и углеводы.
Эти компоненты, поступающие в тонкий кишечник вместе с секретами пищеварительных желез, называют химусом. В пределах микробного цикла смены популяций (как раз – от суток до недели) колебания в составе химуса микробиологически усредняются.
Это обеспечивает равномерное поступление тех двух третей молекул, необходимых для жизнедеятельности человека, которые образуются за счет микробного метаболизма химуса. (Гурманы могут быть разочарованы: на самом деле, поглощая деликатесы они кормят прежде всего не себя, а своих микробов.) Если человек получает достаточно разнообразной пищи – его клетки имеют необходимый для нормального функционирования набор химических веществ.
Можно сказать, что рациональпое питание человека в значительной степени равно рациональному питанию микробов кишечной стенки.
Длительный дефицит каких либо функционально важных продуктов, равно как избыток вредных, или ухудшение качества пищи – причина дискомфорта, снижения качества жизни вплоть до патологических изменений тканей и органов и уменьшение продолжительности самой жизни.
Однако, всякое микробное сообщество субстратспецифично, - его состав зависит от наличия питательных веществ в месте обитания. Применительно к кишечнику и диете это означает что устойчивая смена потребляемой пищи (смена диет) должна приводить к сдвигу в гомеостазе микрофлоры кишечной стенки.
Например, переход на растительную пищу должен проявиться в снижении доли пептолитических видов микроорганизмов (расщепляющих белок), за счет конкурентного увеличения доли целлюлолитиков и других групп микробов, утилизирущих полисахариды. Преобладание углеводов в рационе вегетарианца способствует увеличению их популяции.
Далее по биохимической цепочке в организме-хозяине происходят определенные сдвиги на уровне клеточного метаболизма, которые могут снимать клинические проявления, если они имели место при прежней диете. Равно как и вызывать их при неразумном применении диет, голодания, чрезмерного употребления антибиотиков, некачественных пищевых добавок.
Отсюда вывод: знание реального состава микрофлоры кишечника (кишечной стенки, но не фекалий!) и его мониторинг должны быть полезными для научного обоснования и практической эффективности регулирования комфортности жизни, профилактики и лечения заболеваний методами науки диетологии.
Сведения о микрофлоре кишечника, получаемые при бактериологическом анализе фекалий, ограничены по числу контролируемых видов и точности определения в силу отсутствия возможностей культурального метода исследования с одной стороны и естественных колебаний их состава в зависимости от диеты, возраста, пола и других факторов.
Например, вариации в составе микроорганизмов кишечной стенки разных людей в норме не превышают 50% относительных по отдельным видам и менее 20% по сумме, тогда как в фекалиях субъективные отклонения в концентрации составляют порядок величины по суммарной биомассе и два порядка по отдельным видам. Корректная интерпретация данных в таких условиях требует по крайней мере большого опыта и интуиции. Процесс – подобный воссозданию шедевра классика литературы по содержимому его мусорной корзины.
Такая нестабильность биомассы микроорганизмов и их состава в фекалиях является следствием поддержания гомеостаза пристеночной микрофлоры. Все лишнее – избыточный рост микробов, транзиторные микробы, неусвоенный химус вместе с потоком мукоза является естественным стоком кишечника, который и формирует фекалии.
То есть фекалии – тот буферный резервуар, в который осуществляется сброс излишней, непропорциональной по отношению к гомеостатичному сообществу кишечной стенки, микрофлоры и не принятых к транспорту через слизистую оболочку кишечника компонент химуса и отработанного мукоза с метаболитами микроорганизмов, не угодных макроорганизму.
Как известно, лечение диетой применяют для нормализации микрофлоры при заболеваниях желудочнр-кишечного тракта, как дополнительную терапию при других патологиях или как средство достижения определенного качества кожи, поддержания стабильного веса и физической формы. Обычно для этого применяют натуральные средства и рецепты, уходящие корнями в опыт древних предков.
Но с середины прошлого века в развитых странах широкое применение для этих целей обрели пищевые добавки как натурального происхождения, так и полусинтетические или синтетические. В быт прочно вошли биотехнологические кисломолочные продукты и препараты медицинского назначения, содержащие живые или убитые микроорганизмы не традиционных видов и их композиции.
Кроме того, быстрыми темпами развивается индустрия производства пищевых волокон, препаратов полиненасыщенных жирных кислот и других полезных, несомненно, продуктов так называемого функционального питания.
Это предлагается взамен дефицита соответствующих природных продуктов, который образовался за счет исключения из рациона человека индустриального общества многочисленной группы растений, грубой натуральной пищи, на которой два миллиона лет формировался кишечный микробиоценоз Homo sapience – человека разумного. Это относится в значительной мере к ботаническому разнообразию первобытного человека, употреблявшего «вершки и корешки» лесного и лугового растительного мира.
Вряд ли его можно восполнить пищевыми добавками, которые есть суррогат естественного сырья, зачастую получаемого из отходов производства. Всякая технологическая (химическая, термическая, механическая, биологическая) обработка естественного сырья, направленная на получения некого целевого продукта, приводит к потере других полезных веществ, а нередко – самого продукта. Кроме того, особенно опасны неконтролируемые побочные компоненты, образующиеся в процессе производства, способные принести вред здоровью.
Так что, созданная за миллион лет пищевая детерминанта кишечной микробиоты вряд ли пострадала за сотню лет индустриализации и урбанизации жизни. Тем более, что подавляющая часть населения планеты, обитающая в сельских местностях, или в развивающихся странах до сих пор употребляет натуральную пищу.
Сокращение его ботанического разнообразия пока не выглядит в историческом смысле фатальным. Во-первых по факту продолжения увеличения средней продолжительности жизни от примерно тридцати лет у пещерного человека до 40-50 в средние века и 60-70 в наше время. Отсюда видно, что дело не в ботаническом разнообразии и грубой пище, а благосостоянии популяции. Можно и в наш век назвать народности, живущие растительной пищей и охотным промыслом.
Нетрудно догадаться, что их здоровье и продолжительность жизни значительно меньше чем жителей развитых экономически стран. Выходит, в Японии самая высокая продолжительность жизни не потому, что там наивысший уровень потребления пищевых добавок, а потому, что ее жители одни из самых состоятельных в мире и могут себе позволить прежде всего употреблять в пищу разнообразные растительные, животные, - особенно море-продукты (причем, что важно, свежие!).
Если вам не хватает 3- или 6- омега-полиненасыщенных кислот - полезнее ввести в рацион печень трески или другие морепродукты с высоким содержанием этих веществ, чем покупать в аптеке суррогатные препараты. Лучше употреблять в пищу натуральный виноград, если вам позволяет достаток, чем пополнять дефицит пищевых волокон, покупая патентованные пищевые волокна, приготовленные из виноградных выжимок - отходов виноделия.
Еще о БАД-ах
Еще один важный аспект пищевых добавок – их химическая и биологическая безопасность. Безопасность традиционной природной пищи человек обеспечил своим трагическим опытом, например, отсортировав ядовитые растения от не ядовитых.
Такой способ оценки токсичности пищевых добавок в 21 веке неприемлем. Необходимо исследование их состава и свойств не только в процессе разработки – но и в процессе производства. Если на первой стадии это осуществляется, то на второй, как правило – отсутствует. Нет технологического контроля биологически активных препаратов живых микроорганизмов в пробиотиках или заявляемых в аннотации пищевых добавок активных ингредиентов. Это дорого, потому что требует высоких аналитических технологий.
Нет генетического или масс-спектрометрического анализа микробных композиций и примесных видов в пробиотиках и молочно-кислых продуктах или спектроскопических методов в количественном подтверждении целевых веществ в синтетических продуктах функционального питания. Технологии молекулярных исследований биологических веществ хорошо развиты как раз в Японии.
Возможно, они могут себе позволить контролировать состав и структуру биологически активных веществ в БАДах. Нам попадались препараты морских микроводорослей с заявленным содержанием омега-полиненасыщенных кислот, которые их не содержали.
Масс-спектрометрический анализ показывал, что в пребиотик вместо лактулозы введен сходный по атомному составу, но отличающийся структурно дисахарид лактоза. Есть пищевые добавки с декларированным содержанием растительных флавоноидов, которые таковых не содержат. Есть казусы, происходящие от неосведомленности производителей добавок и их медицинских экспертов. Например, препарат флавоноидов, стимулирующих рост кишечных бактерий предлагается в качестве антимикробного средства и приводится пакет заключений из клиник, это подтверждающий.
Оказывается, это действительно так, но препарат не содержит флавоноидов, а содержит технический антисептик, не прописанный в аннотации. Еще хуже обстоит дело с производством пищевых добавок из отходов производства. В 80-е годы прошлого века это было государственной политикой (кормовой белок, дрожжевые автолизаты и пр.).
Впоследствии это направление было закрыто из-за отрицательного опыта их использования в животноводстве и птицеводстве, рыбоводстве. В девяностые годы оно снова возникло как способ выживания коллективов биотехнологических институтов. Там, где работали грамотные и, главное, искусные химики – получали хорошие препараты.
Например, препарат с высоким содержанием токоферола из шрота красного горького перца. Но все равно, кроме 10% токоферола, он содержал, по данным хромато-масс-спектрометрии, еще порядка двухсот веществ, по большей части не известной биологической активности. Можно полагать, что они, по крайней мере безвредны, так как получены из продуктов, употребляемых в пищу человеком. Тем не менее, опасность их токсических проявлений возникает минимум по трем причинам:
Резкого повышения содержания минорных компонент состава пищевого сырья при неизбежном технологическом концентрировании целевого продукта
Наличия продуктов метаболизма гнилостной микрофлоры при использовании несвежего сырья (что, как правило, имеет место быть)
Изменение структуры природных веществ под действием химической обработки
Последнее неизбежно при производстве, включающем гидролиз животного или растительного сырья сильными кислотами или щелочами. Как показывает хромато-масс-спектрометрический анализ, при гидролизе мясных или рыбных продуктов, кроме двадцати аминокислот, необходимых человеку, образуется еще десятки аминокислот измененной структуры, физиологическое действие которых не предсказуемо.
Такого рода БАДы, если и рекомендовать для использования в пищу, то очень аккуратно, при наличии наукоемких технологий контроля исходного сырья и конечного продукта. Видимо это не реально. По крайней мере – пока. Поэтому возвращаемся к исходной мысли: чтобы быть здоровым и прожить долгую жизнь, надо разнообразно, но умеренно питаться натуральными свежими продуктами.
Синтетическая пища – это скорее для экстремальных ситуаций – тюбики для космонавтов межпланетных кораблей, ограниченных габаритов. Да и то, гуманные фантасты проектируют в своих романах большие корабли для межзвездных полетов с теплицами для овощей и фермами для скота. А пока нам рановато переходить на пищевые волокна под соусом синтетических аминокислот.
Как быть с дисбактериозом?
Лучше с ним не быть. Как говорят врачи – болезнь легче предупредить, чем вылечить (если знать как предупредить). Точно также проблематична сейчас проблема коррекции дисбактериоза кишечника. Врачей специалистов в коррекции дисбактериоза по существу нет и не может быть пока у нас нет рутинного метода его анализа.
Сейчас это искусство терапии вслепую. Масс- спектрометрический метод может претендовать на метод массового контроля пристеночной микробиоты кишечника по микробным маркерам в крови. Во-первых, другого способа нет. Во-вторых, экономически это оправдано тем, что метод оказывается дешевле распространенного сейчас культурально-биохимического.
Предлагаемые на рынке системы для идентификации микроорганизмов (MIS – microbial identification system) стоят от 50 до 120 тыс долларов США и требуют ежегодно асигнований в 60 тыс $ на расходуемые материалы в виде наборов для культивирования и тестирования.
Современный хромасс стоит 65-80 тыс $ при ежегодных расходах на эксплуатацию не более 5 тыс $. Сюда входят более дешевые химреактивы, разовая посуда, прокладки, пипетки, шприцы, а культуральные среды и тестовые субстраты не нужны, так как микробы определяют непосредственно в клиническом материале по молекулярным признакам.
Это при том, что ГХ-МС метод определяет, причем количественно, гораздо более широкий круг микроорганизмов, в том числе не культивируемых и не идентифицируемых традиционным методом. Но они как раз и составляют основную часть микрофлоры кишечника, которую надо регулировать при дисбактериозах, это – эубактерии, клостридии, аэробные актиномицеты, лактобациллы и бактероиды. В-трерьих, есть прецедент широкого использования ГХ-МС как метода рутинного анализа в процедуре антидопингового контроля спортсменов.
Национальные лаборатории (в том числе и российская) имеют в своем арсенале до десятка ГХ-МС систем стоимостью от 100 до 700 тыс $ каждая. В практике средней клиники одного хромасса достаточно для замены (или дополнения) традиционной бактериологической службы.
Первая в мире лаборатория, использующая ГХ-МС систему в диагностике микст-инфекции при эндокардите и послеоперационных осложнениях в кардиохирургии, создана в НЦ ССХ им А.Н.Бакулева в Москве проф. Н.В.Белобородовой.
Итак, как предупредить дисбактериоз? Ответ прост. Прежде всего, важно правильно родить ребенка и натурально вскормить. Затем разнообразно питать всю жизнь, избегая сильных стрессов и не допуская злоупотребления антибиотиками и вредными привычками. Только и всего.

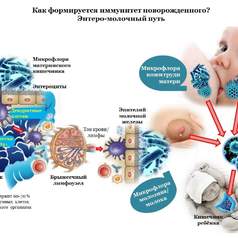
Рис 1. Состав микроорганизмов переходного стула новорожденного (3 суток)
в точности совпадает с вагинальной микрофлорой матери.
Естественный родовой процесс предпочтителен кесареву сечению, поскольку оказывается, что первичное заселение (инокуляция) микроорганизмами кишечника новорожденного происходит при прохождении родовых путей матери. Это по существу вагинальная микрофлора женщины. Ее состав в части доминирующих микроорганизмов (по данным масс-спектрометрии) совпадает с составом фекалий (переходного стула ) младенца третьего дня жизни (рис ..).
До тех пор его кишечным отправлением является так называемый меконий, черная смолоподобная масса, содержащая жизнеспособные микроорганизмы из состава кишечных: пептострептококк, клостридии, лактобациллы, аэробные актиномицеты среди доминирующих видов, а также руминококки, стрептококки, эубактерии, стрептококки и микроскопические грибы. Бифидобактерии и семейство кишечных палочек (Enterobacteriaceae) не обнаружены.
Это исследование, наряду с известными публикациями по микрофлоре мекония, содержит намек на заселение микробами кишечника плода уже при внутриутробном развитии через известный эффект транслокации микроорганизмов с кровью матери. Состав фекалий на пятый день жизни уже близок по многим показателям к норме двенадцатилетнего подростка.
Но часть из них продолжает нормализоваться до полугода. В этот период на кишечной стенке растет численность бифидобактерий и эубактерий, снижается до уровня нормы взрослого количество лактобацилл, энтеробактерий, кокковых форм и микроскопических грибов.
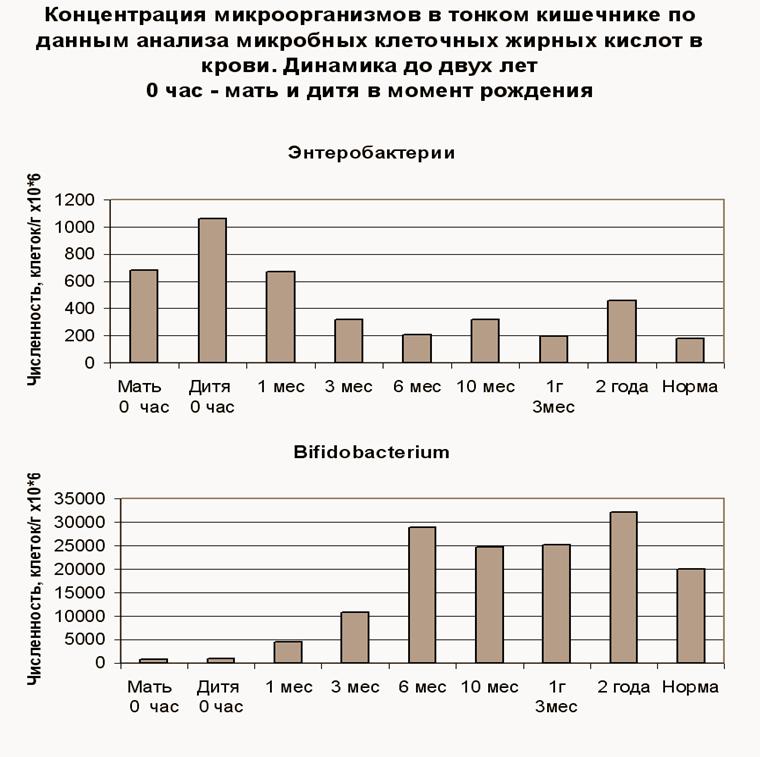
Рис.2. Становление микробиоценоза ребенка происходит примерно в течение полугода. Численность энтеробактерий уменьшается, а бифидобактерий увеличивается до взрослой нормы.
( Часть данных мониторинга методом ГХ-МС микробных маркеров в крови)
Эти данные свидетельствуют о том, что в период первой недели жизни и первых шести месяцев новорожденному должны быть созданы все условия для нормального становления микрофлоры кишечника.
Нюансы микробиоценоза половых органов.
Поскольку микрофлора родовых путей матери является, на языке микробиологов, инокулятом или закваской будущей микрофлоры ребенка, то логично полагать необходимым поддержание ее нормальной в процессе беременности и родов. Нормальность микрофлоры означает гомеостатичность ее качественного и количественного состава при «своих» штаммах, не вызывающих реакции иммунной системы (воспаления).
Это никак не означает стерильности, поскольку все слизистые оболочки и кожа организма человека закономерно содержат микробную биопленку. По аналогии с нормальной микробиотой кишечника микроорганизмы биотопов половых путей женщины также выполняют важные физиологически функции и участвуют в поддержании гомеостаза макроорганизма.
Поддержание относительно стабильного качественного и количественного состава микробиоценоза влагалища имеет важное значение в обеспечении нормального физиологического статуса женского организма. Нормальная микробиота - тот первичный неспецифический барьер, лишь после прорыва которого инициируется включение всех последующих неспецифических и специфических факторов защиты макроорганизма.
Она выступает как чуткий индикатор физиологического состояния макроорганизма в зависимости от воздействия на него различных факторов. Обобщенные сведения по вагинальному микробиоценозу можно найти в фундаментальном руководстве для клиницистов Manual of Clinical Microbiology (1991).Нормальная влагалищная бактериальная флора представлена разнообразными видами микроорганизмов, многие из которых еще не идентифицированы.
Количественный бактериологический анализ вагинального сообщества здоровых женщин показал, что в 1 г вагинальной жидкости содержится 108 клеток аэробных и 109клеток анаэробных бактерий (Hill G.B., 1984; Bartlett J.G., 1977; 1984). Ведущими микроорганизмами являются Lactobacillus, Peptococcus, Bacteroides, Staphilococcus epidermidis, Corinebacterium spp., Peptostreptococcus spp., Eubacterium.
Этот список отражает ранговое расположение доминирующей микробиоты, исходя из концентраций более 105 КОЕ/г. При изучении состава аэробной и анаэробной микрофлоры на протяжении беременности и на 3-й и 6-й неделях после родов многие авторы прослеживают тенденцию нарастания количества лактобактерий в течение беременности при снижении анаэробных видов.
Это свидетельствует о том, что в процессе беременности происходит угнетение влагалищной микробиоты, за исключением лактобактерий. В послеродовом периоде численность грамотрицательных факультативных палочек и большинства анаэробных видов возрастает.
Растет количество коринебактерий , E. сoli, стафилококков, стрептококков, а количество лактобактерий и бифидобактерий уменьшается. Во влагалище у здоровых девочек до момента менархе микрофлора представлена в основном пептококками, пропионибактериями, бифидобактериями, эубактериями, реже бактероидамии; у женщин в период менопаузы и постменопаузы также доминируют Peptococcus, Peptostreptococcus anaerobius, Bacteroides, Eubacterium, тогда как содержание лактобактерий резко уменьшалось. Эти процессы в микробиоценозе влагалища связаны со сниженным уровнем эстрогенов у девочек и у женщин пострепродуктивного возраста.
Большинство патогенных организмов являются компонентами нормальной микрофлоры человека. Данные института Пастера показали, что из 6603 женщин, которые обратились с жалобами на выделения из половых путей, банальная инфекция (стафилококки, стрептококки, кишечная палочка и др.) была выявлена у 35,2% пациенток, Candida аlbicans - у 25% женщин, бактериальный вагиноз - у 17,4%, а далее следовала трихомонадная инфекция (8,2%), Neisseria gonorrhoeae (3,2%).
Только у 10% женщин выявлена нормальная микрофлора влагалища. Наиболее частые возбудители (по литературным данным), представляющие как локализованную, так и генерализованную инфекцию - патогенные стафилококки, стрептококки, Pseudomonas aeurogenosa, Proteus, E.coli, Klebsiella, Serratia, Enterobacter, Flavobacterium meningosepticum, Neisseria meningitidis.
Кроме того, возможно наличие микроскопических грибов (Hamman R.,1982), а также Peptostreptococcus, ассоциированных с Bacteroides и Trichomonas (Brockman J.,1979). У пациенток венерологических клиник определяли Candida, Chlamidia, Trichomonas, Mycoplasma, которые обычно сопутствуют N.gonorrhoae.
У молодых женщин чаще выявлялись Chlamidia trachomatis, у женщин старшего репродуктивного возраста – Trichomonas vaginalis (Person K., 1979). Основными возбудителями заболеваний, передающихся половым путем (ЗПП), являются Neisseria gonorrhoae, Chlamidia trachomatis, Ureaplasma urealyticum, Mycoplasma hominis, Trichomonas vaginalis, Candida albicans и вирус простого герпеса.
Результаты статистического анализа распределения концентраций жирных кислот микробного происхождения в моче, эякуляте и вагинальном содержимом (метод ГХ-МС) свидетельствует о гомеостазе маркеров микроорганизмов в норме, а следовательно, и соответствующего микробиоценоза локусов урогенитального тракта (УГТ).
Статистическая обработка данных позволила выявить два множества (кластера) значений концентраций микробных ЖК. Один из них с меньшим значением средних величин можно отнести к норме, а другой – с высоким средним уровнем – к патологии, т.е. воспалению. Гомеостаз – понятие физиологическое и должно предполагать постоянство как самого микробного сообщества локуса, так и состава и свойств его местообитания.
Действительно, в формировании этих свойств естественным образом должны участвовать и микроорганизмы, которые, так же как и в кишечнике, производят многочисленные биологически активные продукты: ферменты, антибиотики (актиномицеты, стрептомицеты, грибы), регуляторные факторы, витамины но также и токсины, факторы патогенности и пр. Они участвуют в поддержании рН среды и баланса микроэлементов.
Полученные методом ГХ-МС данные подтверждают современное представление об инфекциях УГТ как о полимикробном воспалении. Более того, данные показывают, что ни один из контролируемых таксонов микроорганизмов не сохраняет свою концентрацию в пределах нормы при воспалениях. Здесь понятие таксон может иметь ранг семейства или рода как правило. То есть, на самом деле видовое разнообразие микробиоценоза УГТ в несколько раз шире (за счет видового разнообразия микроорганизмов в роду или семействе), чем мы видим по протоколу исследований.
Следует отметить, что оно напоминает кишечную микробиоту своим качественным составом, в том числе анаэробами, среди которых фигурируют клостридии, бактероиды, бифидобактерии, лактобациллы, фузобактерии, пептострептококки и эубактерии, обитающие в кишечнике. Такую связь отмечают авторы научных публикаций и практикующие врачи. Полученные нами данные еще раз свидетельствуют о том, что причину воспалений органов малого таза надо искать еще и в кишечнике.
Не лишено смысла рассматривать микробное соообщество любых слизистых оболочек в определенной мере подобной кишечнику организованной биопленке. Поводом к тому является стабильность состава каждого из этих микробиоценозов: гомеостаз микробных маркеров имеет место не только в крови (Белобородова, 2000), но и в моче, вагинальном содержимом женщин и эякуляте мужчин (Крымцева, 2003). Их концентрация, измеренная методом ГХ-МС постоянна у здоровых людей, селективно и специфически меняется при воспалениях и возвращается в прежнюю норму после адресного по отношению к агентам воспаления лечения.
Можно полагать, что и в УГТ мы также имеем дело с биопленкой, включающей в подавляющем большинстве компоненты автохтонной микробиоты, присущей человеку. Она специфически переходит в патогенное состояние, включающее набор постоянных агентов (Pseudonocardia, Fusobacterium/Haemophylus, Klebsiella, Streptococcus, Staphylococcus epidermidis и Clostridium perfringens), и прочих членов сообщества, активных периодически.
При таком представлении о микробиоценозе становятся понятными трудности, возникающие при лечении кандидоза, хронических вагинитов, пиелонефритов, уретритов и простатитов. Первой причиной неудач является упорная диагностика модных инфекций (хламидии, микоплазмы, уреаплазмы, гарднерелла, мобилункус, герпес-вирус) при игнорировании патогенного потенциала автохтонной микрофлоры.
Второй причиной являются известные трудности в доставке лекарства к очагу воспаления при болезнях почек, мочевого пузыря и простаты. Третья, пока мало известная клиницистам причина – коллективная сопротивляемость антибиотикам и другим воздействиям (quorum sensing) организованной в биопленку микробиоты локусов.
Приведенные выше соображения показывают, что микробиота слизистых оболочек половых органов женщин не может не являться физиологическим партнером организма-хозяина. Она гомеостатична и играет положительную роль в обменных процессах на слизистой оболочке и защите от внешних патогенов.
В то же время она проявляет и враждебные по отношению к хозяину функции, если состав микробиоты нарушен и токсинообразование, характерное для большинства представителей нормофлоры, становится клинически значимы и может угрожать здоровью женщины. Более того, оно может угрожать и главной физиологической функции женских половых органов – репродуктивной.
У женщин с проблемами беременности или неудачами ЭКО методом ГХ-МС выявляется существенное превышение нормы «скрытыми» (от рутинных методов) компонентами нормофлоры: Clostridium perfringens, Helicobacter pylory, Streptomyces, Eubacterium.
Clostridium perfringens образует как минимум 12 идентифицированных токсинов и энтеротоксин. Мишени для основных токсинов – биологические мембраны в различных тканях. Поражения обуславливают ферментативные процессы, катализирующие гидролитическое расщепление и нарушение клеточной проницаемости с последующим отеком и аутолизом тканей, характерными для газовой гангрены.
Helicobacter pylory , проникая через слизь, прикрепляются к эпителиальным клеткам, проникают в железы слизистой оболочки. ЛПС микроорганизмов способствует миграции нейтрофилов и развитию острого воспаления. Под действием бактериальной уреазы мочевина превращается в аммиак, повреждающий слизистую оболочку.
Фото 7. Хеликобактер в вагинальном содержимом
(предоставлено доктором В.Дворянчиковым).
Eubacterium – родственные клостридиям микроорганизмы, являющиеся одними из основных обитателей кишечника. Условные патогены с развитой системой видов и штаммов с универсальными свойствами.
В том числе для них характерно индуцирование продукции провоспалительных цитокинов и TNF-alfa, а также противовоспалительного цитокина IL-10 (как ЛПС или клеточные токсины Грам+ патогенов). Это обуславливает их участие в патологиях тяжелых заболеваний, таких как, средиземноморская семейная лихорадка, эндокардит, врожденный порок сердца, кожные и кишечные патологии, связанные со сложным изменением концентрации их видов в биотопах.
Streptomyces - аэробные актиномицеты, широко распространеные в окружающей среде, в том числе на стенах сырых помещений, а также в организме человека. Токсигенные штаммы выделяют токсин валиномицин, разрушающий митохондрии клеток млекопитающих (Anderson, 1998).
При наличии такого рода микроорганизмов в детородном органе по отдельности, а тем более при одновременном присутствии, вряд ли будет возможным развитие оплодотворенной яйцеклетки в полноценный плод и нормальное протекание беременности.
Случаи вагинозов
Обнаружены маркеры Neisseria и сопутствующей в таких случаях анаэробной микрофлоры (пептострептококк, бактероиды, фузобактерии, превотелла, Selenomonas). В то же время занижено содержание лактобацилл, бифидобактерий, некоторых клостридий, руминококков, актиномицетов, части эубактерий и других микроорганизмов нормофлоры - вагинальный дисбактериоз.
Превалируют аэробные актиномицеты со стрептококками, бифидобактериями и руминококками. То есть сильно развиты кокковые формы, среди них - Rhodococcus equi, который рассматривают как внутриклеточный условный патоген (аналог гонококка, но менее вирулентный - обычно встречается у мужчин при простатите). Превышают норму некоторые другие бактерии, среди которых заслуживают внимания два вида клостридий.
Ложный кандидоз. Похожую клинику дает Clostridium perfringens при отсутствии Candida albicans. Превышают норму маркеры анаэробных бактерий C. perfringens, Propionibacterium и Butyrivibrio. Завышено содержание маркера Staphylococcus epidermidis.
Энтеробактерии. Эндотоксинемия. Ведущими микроорганизмами являются грамотрицательные микроорганизмы, преимущественно сем. Enterobacteriaceae, которые создают высокие концентрации эндотоксина в локусе и в крови.
Микоз, без участия кандиды. Существенно превышают норму маркеры микроскопических грибов, продуцирующих кампестерол и ситостерол, а также Staphylococcus aureus и клостридии Clostridium propionicum и Clostridium perfringens. Ниже нормы количество многих бактерий, в том числе бифидобактерий и лактобацилл (дисбактериоз).
Ведущая микрофлора представлена бактериями Clostridium perfringens и микроскопическими грибами Candida albicans при наличии Streptococcus (Streptococcus oralis) и грамотрицательных микроорганизмов родов Klebsiella, а также анаэробов Eubacterium.
Специфика микрофлоры половых органов мужчин в норме, при простатите и мужском бесплодии
Заболевания урогенитальной сферы мужчин - уретрит, простатит, орхит до сих пор занимают важное место в проблеме здоровья и продуктивности человека. На рубеже нового тысячелетия проблема простатита требует нового осмысления и вызывает необходимость поиска рациональных подходов к его диагностике и лечению.
Острый и хронический бактериальный простатит занимает два первых места в классификации простатитов Нацинального института здоровья США. Доля инфекционного простатита при этом растет в хронологическом порядке и в настоящее время составляет до 70% - 90% по оценкам разных лабораторий.
Однако определение возбудителя, а тем боле микст-инфекции при простатите (уретрите, орхите, мужском бесплодии) представляет проблему при клиническом или амбулаторном бактериологическом обследовании. Многие микроорганизмы, например, анаэробы и другие трудно культивируемые (коринеформы, микобактерии, микроскопические грибы) избегают детектирования современными методами клинической микробиологии.
Их присутствие в семени и жидкости простаты становится известным лишь благодаря уникальным научным исследованиям, доступным специализированным научным лабораториям. Результатом являются, соответственно, единичные публикации в научной периодике. В изязвлениях мужских половых органов найдены аэробные и анаэробные бактерии, Mycoplasma, Нaemophylus ducrey, Treponema pallidum, Herpes simplex virus, дрожжи и нитчатые грибы. В семени мужчин, страдающих бесплодием, обнаружены E.coli, Staphylococcus, Pseudomonas, Klebsiella, Enterobacter, Bacillus, Neisseria, Corinebacterium, Micrococcus, Proteus, Achromobacter, а также микроскопические грибы.
При инфекционном простатите в разных исследованиях выявлены представители семейства Enterobacteriaceae, бактерии рода Pseudomonas, энтерококки (Enterococcus faecalis, E.faecium и другие), Staphylococcus aureus, Chlamydia trachomatis, Corynebacterium, Staphylococcus, Peptostreptococcus, Streptococcus, and Escherichia, Flavobacterium spp., Pseudomonas testosteroni.
Исследование ДНК секрета и биоптатов простаты свидетельствует о наличии в них микроорганизмов, отличающихся от микробиоты кожи и прямой кишки, и, следовательно, не обнаруживаемых традиционными методами. Действительно, генетическим методом удалось определить в семени наличие 15 видов необычных анаэробов родов Peptostreptococcus, Prevotella, Corinebacterium, Rubrivirax, Actinobacillus, Veilonella и Eubacterium, а также трех аэробов: Streptococcus salivarius, S.pneumoniae и Burkholderia picketii.
Как неожиданность воспринимается обнаружение в секрете простаты превалирующего количества недектируемых в обычной клинической практике коринеформных бактерий, причем в сложном сообществе с Staphylococcus, Peptostreptococcus, Streptococcus и Escherichia, состав которого различен у разных пациентов.
Кроме того, обнаружены микробные ассоциации и у здоровых мужчин, однако иные, чем у больных и в меньшей концентрации. Следует отметить важное для диагностики инфекции обстоятельство, которое состоит в том, что микробные колонии могут быть локализованы в полисахаридных капсулах. Как показали электронно-микроскопические исследования, они покрывают стенки простаты и протоки при хроническом бактериальном простатите.
В таких случаях бактерии не могут выходить из капсулы и, следовательно, быть обнаружены методами, использующими выделение целых микроорганизмов. Однако их присутствие можно выявить и количественно оценить путем детектирования микробных маркеров - малых молекул, составляющих материал клеточной стенки микроорганизмов - бактерий, грибов, простейших, метаболитов вирусов в семени или секрете простаты. Тканевые, клеточные и капсульные барьеры не являются преградой для таких молекул - они, в отличие от микробных клеток, свободно их проходят и могут быть измерены методом ГХ-МС.
Обширная колонизация генитальных органов и мочевыводящих путей предполагает множественность бактериальных агентов воспалений. Ясно, что успех лечения заболеваний микробного происхождения зависит от эффективности диагностики инфекции. Однако методы микробиологического анализа, применяемые в клиниках и медицинских центрах, позволяют одновременно определять один или несколько организмов из многих видов, агентов внешней инфекции или колонизирующих организм человека и являющихся потенциальными патогенами.
Уникальные возможности в этом отношении дает метод ГХ-МС. В отличие от других методов он является количественным, т.е. позволяет определять точно и воспроизводимо во времени количество микробных клеток каждого микроорганизма, колонизирующего область простаты. Сотни измерений концентрации микробных маркеров, проведенные нами в норме и при воспалительных процессах в генитальных органах, при соответствующей статистической обработке современными методами, позволили определить клинически значимые концентрации маркеров.
Это позволяет фиксировать переход соответствующего микроорганизма из состояния симбионта в состояние патогена и применить к нему методы антимикробной терапии. По порядку величины уровень клинически значимых концентраций маркеров соответствует известным измерениям и составляет 104-105 клеток в пробе.
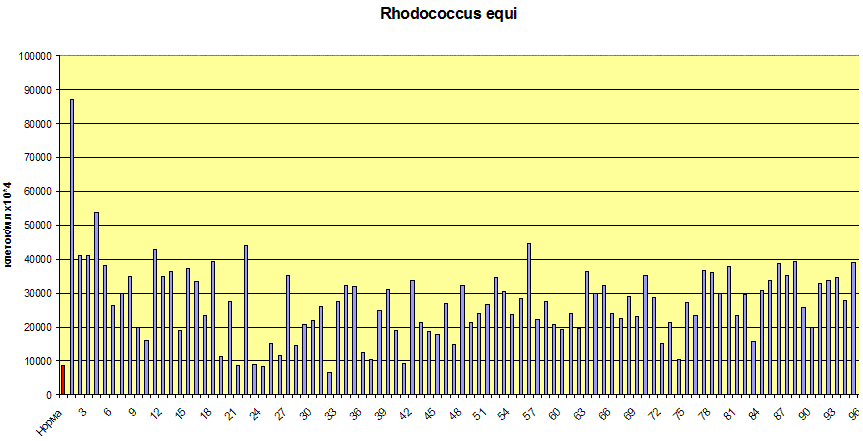
Рис.3. Распределение концентраций 10-метил-гексадекановой кислоты - маркера Rhodococcus equi в эякуляте мужчин. Норма – красный столбик слева.
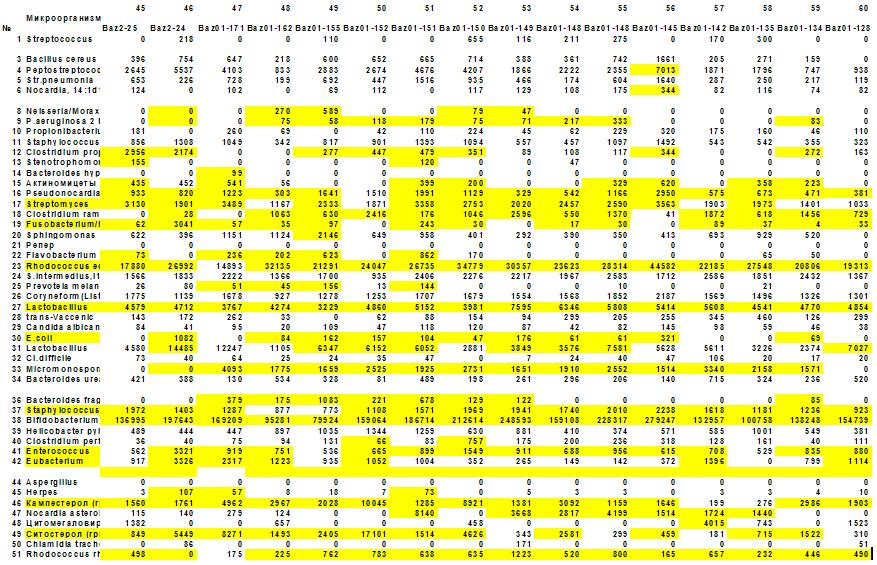
Рис. 4. Матрица микробного сообщества зоны половых органов больных простатитом. Реконструирована по данным ГХ-МС анализа микробных маркеров в эякуляте. По вертикали – 50 микробов, населяющих половые органы мужчин, по горизонтали – 16 из 100 обследованных пациентов. В ячейках концентрация микробов. Желтым цветом выделены ячейки с превышением нормы в два и более раз. Матрица преимущественно полосатая – избыточный рост одних и тех же микробов у всех (или большинства) обследованных.
Масс спектрометрическое исследование 300 пациентов подтверждают приведенные выше данные по видовому составу микрофлоры при заболеваниях УГТ у мужчин. Новизна подхода состоит в одновременном количественном анализе ее изменений в патологии в сравнении с нормой и обнаружении ряда новых микроорганизмов из числа некультивируемых.
Выявлено, что при простатите существенно увеличивается концентрация аэробных актиномицетов (Rhodococcus equi – рис…- и Streptomyces spp), анаэробов рода Eubacterium и микроскопических грибов, продуцирующих кампестерол и ситостерол. Специфичность статистических изменений легко проследить на матрице изменений микрофлоры половых органов мужчин (рис…), из которой видно, что десять микробов из числа 50 контролируемых почти в 100 % случаев (n=100) превышают уровень клинической значимости (ячейки выделены желтым цветом).
Это Streptomyces, Fusobacterium/Haemophylus, Rhodococcus equi, Streptococcus, Enterobacteriaceae spp, Staphylococcus spp, Enterococcus, Eubacterium и микроскопические грибы. Остальные микробы более или менее часто сопутствуют этой основной группе, представляющей специфическую смешанную «инфекцию» при простатите.
Инфекцию в кавычках, потому что все перечисленные виды микроорганизмов являются представителями автохтонной (или индигенной) – то есть присущей человеку микрофлоры. Увеличение их концентрации в месте обитания вероятно (но не обязательно) связано с их переходом в патогенное по отношению к хозяину состояние. Интересно обнаружение Rhodococcus equi (лошадиный розовый кокк – в переводе с латыни) – микроорганизма, изначально обнаруженного в лошадиных фекалиях.
Кроме лошади, он широко распространен в почвах. Наверное, не удивительно, что он прижился и в человеке, вследствие его многовекового соседства с этим домашним и боевым животным. Есть основание предполагать существенную роль родококков в воспалении, поскольку они являются условно-патогенными внутриклеточными паразитами. И в этом свойстве можно усмотреть их аналогию гонококку.
Несколько слов о матрице. Она представляет собой наглядное статистическое описание микробной этиологии воспалительного процесса или дисбактериоза. Возможно, она дает информацию врачу о выборе универсальной схемы лечения, если нет под руками масс-спектрометра.
Продолжение. Часть 3...
Источник: https://disbak.ru/nauchnye-publikatsii/nevidimyy-organ-mikroflora-cheloveka-chast-2.html
© ГастроПорта