Введение
Нормальная микрофлора человека или микробиота рассматривается как качественное и количественное соотношение популяций микробов отдельных органов и систем, поддерживающих биохимическое, метаболическое и иммунологическое равновесие организма хозяина [4,13].
При детальном исследовании 13.355 образцов, полученных при колоноскопии различных отделов кишечника трех добровольцев, мукозная микрофлора которых была подвергнута анализу на гомологию секвенированных генов 16S рРНК, показали, что пристеночная и просветная микрофлора включает 395 филогенетически обособленных групп микроорганизмов, из которых 244(62%) являются абсолютно новыми.
При этом 80% новых видов, выявленных при секвенировании, относятся к некультивируемым даже при анаэробных условиях. Большинство из предполагаемых новых видов микроорганизмов являются представителями таксонов Firmicutes и Bacteroides [22].
В связи с тем, что основная роль в поддержании нормобиоценоза пока отведена представителям родов Bifidobacterium, Lactobacillus, Enterococcus и Escherichia, выполняющим ряд важных для организма человека функций, целью настоящего сообщения является характеристика поликомпонентных препаратов-пробиотиков, применяемых для терапии и профилактики дисфункций желудочно-кишечного тракта.
Функции нормальной микрофлоры кишечника.
Известно, что нормальная микрофлора кишечника обеспечивает колонизационную резистентность открытых полостей организма хозяина, стимуляцию кишечного ангиогенеза и иммунного статуса, регуляцию липидного обмена, поддержание оптимального уровня метаболических и ферментативных процессов, антитоксическое, антимутагенное и антиканцерогенное действие [2-4,27].
Показано, что в проявлении антагонистического эффекта нормальной микрофлоры, дополнительно к антимикробному действию различных органических кислот, включая короткоцепочечные жирные кислоты, важное значение имеют перекись водорода, микробный лизоцим и низкомолекулярные субстанции – лантибиотики и микроцины, обладающие широким спектром антагонистической активности и составляющие группу «естественных» антибиотиков [4,31].
Изучение иммуномодулирующих свойств индигенных штаммов кишечной палочки, энтерококков, лактобацилл, бифидобактерий и бактероидов, выявило их способность воздействовать на различные звенья иммунной системы, регулируя неспецифический и специфический клеточный и гуморальный иммунитет, включая активацию синтеза провоспалительных и противовоспалительных цитокинов [4,11,27].
Дисбактериоз кишечника (микроэкологические нарушения желудочно-кишечного тракта), рассматривается как клинико-лабораторный синдром, возникающий при целом ряде заболеваний и клинических ситуаций, который характеризуется изменением качественного и/или количественного состава нормофлоры определенного биотопа, а также транслокацией различных ее представителей в несвойственные биотопы, а также метаболическими и иммунными нарушениями, сопровождающимися у части пациентов клиническими симптомами [2, 13].
Наблюдаемое в настоящее время увеличение частоты и тяжести острых инфекционных заболеваний, торпидное течение и хронизация воспалительных процессов различной локализации в ряде случаев ассоциируются с микроэкологическими нарушениями, т.е. развившимся дисбактериозом, сопровождающим основную болезнь.
В гастроэнтерологии болезни кишечника ассоциируются с различными синдромами: синдром избыточного бактериального роста в тонкой кишке, синдром раздраженного кишечника, постинфекционный синдром раздраженного кишечника, синдром нарушенного всасывания, воспалительные болезни кишечника, хроническая диарея, неспецифический язвенный колит и др. [14,16,20,23].
В последние годы этиопатогенез синдромов раздраженного кишечника и избыточного бактериального роста в тонкой кишке рассматривается с позиции микроэкологических нарушений желудочно-кишечного тракта.
Синдром раздраженного кишечника определяется как комплекс функциональных кишечных нарушений, продолжительностью свыше 12 недель за истекший год, включающий в себя боль в животе, уменьшающуюся после акта дефекации, разнообразные кишечные расстройства, в том числе, метеоризм, поносы, запоры или их чередование, чувство неполного опорожнения кишечника и императивные позывы на дефекацию [14].
Следует указать, что синдром раздраженного кишечника распространен повсеместно, от которого на всем земном шаре страдают около миллиарда жителей.
Синдром избыточного бактериального роста в тонкой кишки тесным образом связан с увеличением общей обсемененности биотопа (выше 105 КОЕ/мл) энтеробактериями, бактероидами, клостридиями, фузобактериями и развивается при недостатке ингибирования бактерий при их поступлении из толстой кишки (атония, стаз, шунты), сопровождающегося увеличением проницаемости кишечного барьера с явлениями хронической диареи и интоксикации.
Нарушение кишечного всасывания обусловливает В12-дефицитную анемию, гиповитаминоз и белковую недостаточность. Популяционный уровень основных представителей микрофлоры тощей, подвздошной и толстой кишки здоровых людей представлен в таблицах 1 и 2, составленных на основе обобщенных данных различных авторов [4,6,15].
Таблица 1. Популяционный уровень представителей микрофлоры тощей и
подвздошной кишки
Состав микрофлоры
Тощая кишка
Подвздошная
кишка
Аэробные, факультативно анаэробные бактерии
Энтеробактерии
0-103
102 -106
Стрептококки
0-104
102 -106
Стафилококки
0-103
102 -105
Лактобактерии
0-104
102 -105
Грибы
0-102
102 –103
Анаэробные бактерии
Бактероиды
0-102
103-107
Бифидобактерии
0-103
103-105
Пептококки, пептострептококки
0-103
102-105
Клостридии
Редко
102-104
Эубактерии
Редко
Редко
Общая обсемененность
0-105
103-107
Недавно при бактериологическом исследовании образов, полученных из тощей кишки 63 больных, страдающих хронической диареей или малабсорбцией, синдром избыточного бактериального роста в тонкой кишке был подтвержден только у 55 пациентов. Было установлено, что общее количество бактерий (обсемененность тонкой кишки), рассчитанное для 55 больных), составило 7,6± 0,8 КОЕ/мл, при этом количество анаэробов было 6,1 ± 0,7 КОЕ/мл и микроаэрофилов – 7,4 ± 0,9 КОЕ/мл. Частота встречаемости (%) и популяционный уровень бактерий различных видов, содержащихся в тощей кишке у этих 55 больных с синдром избыточного бактериального роста в тонкой кишке, представлены в табл.3 [20].
Таблица 2. Качественный и количественный состав микрофлоры толстой кишки у здоровых людей (КОЕ/ г фекалий)
Наименование
микроорганизмов
Дети раннего возраста
Взрослые
Люди пожилого
возраста
Бифидобактерии
>109
109-1010
108-109
Лактобактерии
>106
107-109
106-107
Бактероиды
1010-1011
109-1010
109-1011
Фузобактерии
108-109
107-1010
108-109
Эубактерии
109-1010
107-1010
109-1010
Пептострептококки
109-1010
109-1010
109-1010
Клостридии:
лецитиназонегативные
лецитиназапозитивные
> 107
> 105
106-108
105-106
108-109
105-107
Энтерококки
106-107
107-108
106-107
E.coli:
типичные
гемолитические
лактозонегативные
107-108
101-102
<105
106-108
103
<105
107-108
>103
<106
Условно патогенные
энтеробактерии*
<104-106
<104-105
<105
Стафилококки:
коагулазонегативные
золотистые
104- 106
102-103
< 104
103
< 104
103
Аэробные бациллы
< 103
< 105
< 105
Pseudomonas spp. Acinetobacter spp.
< 103
< 108
< 103
< 106
< 104
< 106
Дрожжеподобные грибы рода Candida
< 105
< 104
< 105
• Представители родов Klebsiella, Enterobacter, Hafnia, Serratia, Proteus, Morganella, Providencia, Citrobacter, и др.
При микроэкологических нарушениях желудочно-кишечного тракта часто наблюдаются признаки бронхиальной астмы, возникновение аллергодерматозов и нейродермитов, степень выраженности которых в разных случаях различна [8,9].
При нарушении нормальной микрофлоры в ряде случаев увеличивается популяционный уровень условно патогенных бактерий, вырабатывающих различные протеолитические ферменты, усугубляющие течение патологического процесса (табл.4).
Таблица 3. Микрофлора тощей кишки 55 пациентов с синдромом избыточного роста в тонкой кишке [20].
Бактерии
Частота встречаемости различных видов бактерий (n=55)*
Частота (%)
lg КОЕ/мл
- Lactobacillus
75
6,1 ± 1,1
- Streptococcus
71
6, 2 ± 0,8
- Escherichia coli
69
7,2 ± 0,9
- Bacteroides
29
6,9 ± 1,3
- Clostridium
25
5,5 ± 1,0
- Vellonella
-
25
5,3 ± 0,7
- Staphylococcus
25
6,2 ± 0,6
- Micrococcus
22
6,0 ± 0,7
- Klebsiella
20
7,1 ± 0,8
- Neisseria
16
6,5 ± 0,4
- Peptosteptococcus
13
6,1 ± 0,7
- Fusobacterium
13
4,8 ± 0,5
- Proteus
11
6,1 ± 0,8
- Acinetobacter
9
8,0 ± 2,2
- Enterobacter
7
7,3 ± 0,2
Таблица 4. Повреждающее действие протеолитических ферментов при микроэкологических изменениях кишечника.
Патогенетическое действие протеолитических ферментов в кишечнике
Эффекты действия ингибиторов
протеолитических ферментов бактерий
1. Стимуляция образования медиаторов воспаления.
2. Нарушения микроциркуляции и свертываемости крови.
3. Увеличение проницаемости клеточных мембран.
4. Гипоксия тканей, повреждение.
5. Снижение барьерной функции слизистых оболочек.
Источник: тканевые протеазы, протеолитические ферменты условно патогенных микробов.
1. Торможение эндогенных и микробных протеаз.
2. Уменьшение выработки медиаторов воспаления.
3. Стабилизация мембран клеток.
4. Гипосенсибилизирующее действие.
5. Ростстимулирующая активность представителей нормальной микрофлоры.
6. Блокирование образования кининогена, кинина и фибринолиза.
7. Стимуляция функции захвата антигена макрофагами, их переваривающей способности.
8. Снижение протеолитической активноси катепсина Д-макрофагов.
Таким образом, при установлении диагноза основного заболевания с сопутствующими микроэкологическими изменениями действие врача должно быть направлено на терапию основного заболевания и устранение факторов, вызывавших нарушение нормальной микрофлоры.
Комплексная терапия должна включать пробиотические препараты, которые в настоящее время принято подразделять на 3 основные группы: пробиотики, пребиотики и синбиотики [2 -5, 21, 24, 26].
Пробиотики – это живые микроорганизмы и вещества микробного происхождения, оказывающие при естественном способе введения позитивные эффекты на физиологические, биохимические и иммунные реакции организма хозяина через стабилизацию и оптимизацию функции его нормальной микрофлоры.
Пребиотики – это препараты немикробного происхождения, способные оказывать позитивный эффект на организм хозяина через селективную стимуляцию роста или усиления метаболической активности нормальной микрофлоры кишечника. В эту группу входят препараты, относящиеся к различным фармакотерапевтическим группам, но обладающие общим свойством – стимулирововать рост и развитие нормальной микрофлоры кишечника.
Синбиотики - это препараты, полученные в результате рациональной комбинации пробиотиков и пребиотиков. Как нами указано выше, целью настоящей работы является характеристика зарегистрированных в Российской Федерации поликомпонетных препаратов-пробиотиков.
Биологически активные добавки к пище, обогащенные различными пробиотическими культурами, регистрируются отдельно от лекарственных средств и производственные серии БАД не поступают на контроль в ГИСК им.Л.А.Тарасевича [18].
Краткая характеристика представителей родов Bifidobacterium, Lactobacillus, Enterococcus и индигенных Escherichia coli.
Пробиотики, содержащие жизнеспособные бактерии 4-х указанных таксономических групп широко применяются при острых кишечных инфекциях бактериальной и вирусной природы и в случаях, когда они назначаются после проведенного курса этиотропной антибактериальной терапии.
При приеме внутрь живые микроорганизмы колонизируют слизистую соответствующих отделов кишечника, метаболиты которых изменяют pH среды, а антибиотико-подобные вещества (бактериоцины) подавляют рост и развитие патогенных и условно патогенных микроорганизмов.
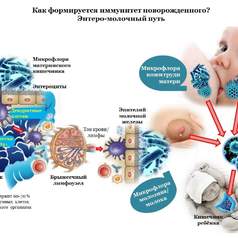
Профилактику дисбактериоза следует начинать с момента формирования нормофлоры новорожденного, получаемой от матери. В связи с этим рекомендуется включать в рацион питания беременных женщин различные препараты-пробиотики стабилизирующие нормальную микрофлору как желудочно-кишечного тракта, так и вульвовагинальный биотоп.
Предпочтительными в данном случае являются комбинированные препараты-пробиотики, содержащие антагонистически активные штаммы бифидобактерий и лактобацилл.
Бифидобактерии - это анаэробные бактерии, морфологически представляющие собой чрезвычайно вариабельные по форме грамположительные неспорообразующие палочки несколько изогнутые, булавовидные и часто разветвленные.
Концы клеток бифидобактерий могут быть раздвоены, утончены или утолщены в виде шаровидных вздутий. Расположение клеток одиночное, парами, V-образное, иногда цепочками или розетками.
Большая часть бифидобактерий располагается в толстой кишке, являясь ее основной пристеночной и просветной микрофлорой. У детей они составляют большую часть всех микроорганизмов кишечника в зависимости от возраста.
Так, бифидобактерии занимают доминирующее положение в микробном пейзаже кишечника у здоровых новорожденных детей, находящихся на естественном вскармливании, к 5-20 дню после рождения. В норме количество бифидобактерий у грудных детей составляет 1010- 1011 КОЕ/г фекалий, у детей старшего возраста и у взрослых - 109-1010 КОЕ/г.
Лактобациллы представляют собой неспорообразующие грамположительные палочки, обычно правильной формы, длинные, иногда кокковидные, располагающиеся в коротких цепочках или по одиночке.
Лактобациллы заселяют организм новорожденного ребенка в раннем постнатальном периоде. Средой обитания лактобацилл являются различные отделы желудочно-кишечного тракта, начиная с полости рта и кончая толстой кишкой, где они поддерживают pH на уровне 5,5-5,6.
Присутствуя постоянно в организме, в ряде периодов жизни девочек и женщин репродуктивного возраста, они являются превалирующей флорой вульвы и вагины. Лактобациллы удается обнаружить в молоке человека и животных.
В желудке лактобациллы содержатся в количестве 102 - 103 КОЕ/мл желудочного сока, в тонкой кишке - до 103 - 104 КОЕ/мл кишечного сока, в толстой (в зависимости от возраста) - 106 -107 КОЕ/г фекалий, в вагине - 106- 109 КОЕ/мл отделяемого (в зависимости от возраста).
Лактобактерии в процессе жизнедеятельности вступают в сложное взаимодействие с другими микроорганизмами, в результате чего подавляются гнилостные и гноеродные условно патогенные микроорганизмы, в первую очередь протеи, а также возбудители острых кишечных инфекций.
В процессе нормального метаболизма они способны образовывать молочную кислоту, перекись водорода, продуцировать лизоцим и вещества с антибиотической активностью: реутерин, плантарицин, лактоцидин, лактолин.
Лактобациллы является вторым основным микробиологическим звеном формирования колонизационной резистентности открытых полостей организма хозяина.
Энтерококки - встречаются в кишечнике в количествах 105-107 КОЕ/г фекалий и в норме не превышают общее количество кишечных палочек. Энтерококки осуществляют метаболизм бродильного типа, ферментируют разнообразные углеводы с образованием в основном молочной кислоты, но не газа, снижая рН до 4.2-4.6.
В некоторых случаях восстанавливают нитрат, обычно лактозопозитивные. В экспериментах на гнотобионтах было показано, что при выведении стерильных животных за барьер без оральной аппликации энтерококков, у животных наблюдается развитие летальной вирусной инфекции.
Escherichia coli первые заселяют кишечник новорожденных, подготавливая среду для анаэробных микроорганизмов, поглощая кислород, диффундирующий из системного кровотока через кишечную стенку в просвет кишечника.
Эксперименты по заселению микробов в кишечник гнотобиологических животных показали, что анаэробные бактерии приживаются в желудочно-кишечном тракте только после его колонизации аэробными бактериями, в первую очередь эшерихиями.
Известно, что эшерихии способствуют гидролизу лактозы, участвуют в расщеплении белков и углеводов, метаболических превращениях холестерина, жирных и желчных кислот, синтезируют витамины комплекса В, биотин, витамин К, никотиновую и пантотеновую кислоты.
Регуляторами роста бактерий в кишечнике являются различные экзоэнзимы и бактериоцины. Синтезируемые бактериоцины отличаются мол. массой и спектром антимикробной активности.
Так, колицины, имеющие высокую м.м., характеризуются узким спектром антибактериального действия, так как специфически подавляют рост бактерий того же или филогенетически родственных видов, в то время как микроцины, имеющие низкую м.м., обладают широким спектром антагонистической активности.
Колонизация слизистых кишечника эшерихиями определяет также возможность их конкуренции с условно патогенными бактериями за источники питания.
Немаловажной является способность ЛПС (липополисахарида) эшерихий и, по-видимому, бактероидов, вызывать значимую неспецифическую стимуляцию гуморального и клеточного иммунитета, индуцируя синтез нейтрофилокинов, регулирующих кооперативное взаимодействие фагоцитов, а также синтез ряда провоспалительных цитокинов (ФНО-α, IL-1, IL-6 и др.), важных для кооперативного взаимодействия иммунокомпетентных клеток.
ЛПС эшерихии играют важную роль в поддержании антиэндотоксинового иммунитета, обеспечивающего защиту макроорганизма от эндотоксинового шока. В кишечнике человека эшерихии появляются в первые дни после рождения в количестве 107- 108 КОЕ/г фекалий и сохраняются на протяжении жизни на уровне 106 - 108 КОЕ/г содержимого толстой кишки.
Безопасность (безвредность) пробиотических штаммов.
Следует отметить, что безвредность пробиотических штаммов бифидобактерий и лактобацилл серьезных сомнений не вызывает, в то время как штаммы энтерококков и эшерихий, среди которых встречаются патогенные варианты, требуют доказательства их авирулентности.
Авирулентность пробиотического штамма E.coli M-17, применяемого в СССР и РФ с середины 50-х годов XX века в составе препарата “Колибактерин”, показана только на основе фенотипических свойств и безвредности на лабораторных животных и добровольцах. Применение колибактерина на миллионах Россиян подтверждает безвредность пробиотического штамма E.coli M-17.
Штамм Enterococcus faecium SF68 был выделен и запатентован S.A.Giuliani (Patent № 1.112.479). На основе этого штамма были созданы препараты “Bioflorin” и “Iodoform” (аналог Бифиформа), широко применяемые в Западной Европе. Штамм Enterococcus faecium SF68 входит в состав зарегистрированных в РФ пробиотиков “Бифиформ” и “Линекс”.
Что же в настоящее время вызывает беспокойство исследователей относительно “патогенизации” энтерококков и кишечных палочек? Это то, что недавно в составе генома ряда возбудителей бактериальных инфекций обнаружены геномные "острова" патогенности.
Под островами патогенности принято понимать фрагменты ДНК, размерами от 1-10 kb (островки) или от 10-20 до 200 kb (острова) соответственно, включающие дискретные гены вирулентности и обнаруживаемые только у патогенных микроорганизмов.
Указанные фрагменты ДНК отличаются от бактериального генома по содержанию % G+C и, как правило, фланкированы DR (directly repeated) нуклеотидными повторами. Острова патогенности часто ассоциированы с 3' областью локусов различных транспортных РНК, что обеспечивает им способность к распространению среди одного или родственных видов бактерий путем естественной конъюгации, трансдукцией или трансформацией.
Такая мобильность островов патогенности связана с тем, что они могут входить в состав транспозонов, плазмид или генома бактериофагов, определяющих возможность горизонтального переноса генетической информации.
Именно интеграция, стабилизация и экспрессия генов вирулентности, входящих в состав островов патогенности, и лежит в основе формирования новых свойств, в том числе вирулентных, у родственных непатогенных видов бактерий различных таксономических групп [1].
В соответствии с возникшей проблемой на сегодняшний день можно констатировать, что в геноме бактерий пробиотического штамма Enterococcus faecium SF68 при использовании ПЦР А.Н.Суворовым с соавт. не обнаружены известные для патогенных клинических изолятов энтерококков гены вирулентности: gelE (gelatinize), sprE(serine protease),esp(extracellular surface protein), fsrB(virulence factor regulator) asa1(aggregation substance) [17].
Полученные ранее данные о безопасности штамма в опытах на лабораторных животных, данные проведенных в двойных слепых плацебо контролируемых клинических испытаниях препарата-пробиотика, дополненные молекулярно-биологическими исследованиями, позволяют отнести штамм E.faecium SF68 к безопасным [17,19,35].
Проблема лекарственной устойчивости пробиотических культур. Немаловажной является также проблема лекарственной устойчивости и возможная роль пробиотических культур в распространении генов антибиотикорезистности.
Недавно при изучении 187 культур, выделенных из различных йогуртов, производимых в 8 странах Европейского Союза, была обнаружена устойчивость к канамицину у 79% изолятов, к ванкромицину у 65%, к тетрациклину у 26%, пенициллину у 23%, эритромицнну у 16% и хлорамфениколу у 11%, при этом большая часть культур (68,4%) характеризовались множественной лекарственной устойчивостью [34].
В опытах in vitro показана возможность передачи R-плазмид от диких культур Lactobacillus spp. различным видам грампозитивных бактерий и продемонстрирована передача плазмиды pAM-β от Lactobacillus reuteri к Enterococcus faecalis в процессе приготовления мясомолочной продукции [25].
Эти находки настораживают и требуют контроля стартерных культур молочнокислых бактерий, используемых для производства продуктов питания, на отсутствие мобильных генетических элементов, включающих гены антибиотикорезистентности.
Можно лишь отметить, что бактерии пробиотического штамма E.faecium SF68 чувствительны к ванкомицину, ампициллину, пиперациллину, тетрациклину, хлорамфениколу, эритромицину, имипенему, ципрофлоксацину и фузидиевой кислоте и устойчивы к метициллину, цефуроксину, азтреонаму, мипрамину, тобрамицину, стрептомицину и тетрациклину [17].
Ниже мы останавливаемся на характеристике поликомпонентных препаратов-пробиотиков, в том числе комбинированных и сорбированных, включающих в свой состав бифидобактерии, лактобациллы, энтерококки и эшерихии в различном сочетании.
Поликомпонетные и комбинированные препараты-пробиотики.
К поликомпонетным препаратам-пробиотикам относятся бифиформ, бификол, линекс и ацилакт. К комбинированным препаратам-пробиотикам следует относить бифилиз, аципол, кипацид. Отдельную группу составляют сорбированные пробиотики (табл.5).
Основным действующим началом этих препаратов являются живые пробиотические бактерии, относящиеся к категории GRAS (generally regarded as safe), обладающие антагонистической активностью против широкого спектра патогенных и условно патогенных бактерий, основное назначение – обеспечение нормализации микрофлоры открытых полостей организма хозяина.
Бифиформ. Препарат выпускается в двух вариантах: Бифиформ для взрослых и Бифиформ для малышей. Бифиформ для взрослых представляет собой высушенную микробную массу живых Bifidobacterium longum ATCC 15707 и Enterococcus faecium SF68. В каждой капсуле содержится высокая концентрация бактерий каждого штамма - не менее 107 КОЕ.
Бифиформ малыш имеет другой состав пробиотических культур: Bifidobacterium lactis Bb-12 и Lactobacillus rhamnosus GG в дозе 109 КОЕ в табл. каждого штамма.
По сравнению с другими бифидосодержащими препаратами бифиформ имеет ряд преимуществ: (1) капсула препарата кислотоустойчива, т.е. не растворяется соляной кислотой и пепсином, что обеспечивает высвобождение в кишечнике высоких концентраций содержащихся в препарате бактерий практически без их инактивации на уровне желудка, (2) наличие в препарате компонентов, ускоряющих транзиторную колонизацию ЖКТ экзогенными пробиотическими бактериями.
Известно, что представители родов Bifidobacterium, Lactobacillus Enterococcus и Escherichia, относящиеся к нормальной микрофлоре, колонизируют как просвет желудочно-кишечного тракта (полостная микрофлора), так и поверхность слизистой оболочки, формируя пристеночную или мукозную микробиоту. Большая часть указанных бактерий располагается в толстой кишке, присутствуя в кишечнике на протяжении всей жизни.
Продолжение. Часть 2...
Источник: https://disbak.ru/nauchnye-publikatsii/polikomponentnye-probiotiki-terapevticheskiy-effekt-pri-disbiozah-kishechnika-i-mehanizm-deystviya-chast-1.html
© ГастроПорта