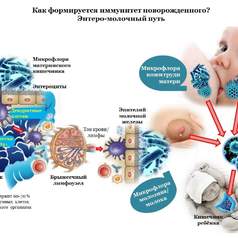
Продолжение. Часть 2
Б.А.Шендеров, доктор медицинских наук, профессор
Московский государственный университет пищевых производств,
ФГУН “Московский НИИ эпидемиологии и микробиологии” им. Г.Н.Габричевского
Впервые термин «пробиотики» был внедрен в 1954 году F. Vergio, который в своей монографии «Anti- und Probiotika» проводил сравнение различных соединений, обладающих как антимикробными, так и позитивными эффектами на кишечную микрофлору.
В последующем Lilly и Stillwell (1965) под термином пробиотики предложили понимать живые микроорганизмы, усиливающие рост других микроорганизмов [4; 7].
К настоящему времени за рубежом разработаны и коммерчески реализуются, в том числе и на российском рынке, как моно, так и некоторые комплексные пробиотики, состоящие из двух-пяти различных лиофильно высушенных живых микроорганизмов (табл. 7,8).
Таблица 7. Наиболее распространенные штаммы лактобацилл и бифидобактерий, используемые в России для производства пробиотиков и продуктов функционального питания
Lactobacillus acidophilus 100аш; NK1; K3Ш24; Ер317/402
Lactobacillus fermentum 90-TC-4
Lactobacillus plantarum 8RA-3
Bifidobacterium bifidum 1; 791; ЛВА-3
Bifidobacterium longum B379M
Bifidobacterium breve 79119; 79-88
Bifidobacterium infantis Г 73-15; 79-43
Bifidobacterium adolescentis 7513; MC-42; Г013
Таблица 8. Наиболее распространенные штаммы лактобацилл и бифидобактерий, используемые за рубежом для производства пробиотиков и продуктов функционального питания [6]
Штаммы
Фирма-производитель
L.acidophilus NCFM
Rhodia Inc.
L.acidophilus DDS-1
Nebraska Cultures
L.acidophilus SBT-2062
Snow Brand Milk Products
L.acidophilus LA-1/ LA-5
Chr. Hansen
L.casei Shirota
Yakult
L.casei Immunitas
Danone
L.fermentum RC-14
Urex Biotech
L. johnsonii La 1/Lj1
Nestle
L.paracasei CRL 431
Chr.Hansen
L.plantarum
Probi AB
L.reuteri SD 2112/MM2
Biogai
L.rhamnosus GG
Valio
L.rhamnosus GR-1
Urex Biotech
L.rhamnosus 271
Probi AB
L.rhamnosus LB21
Essum AB
L.salivarius UCC 118
University College Cork
L.lactis L 1A
Probi AB
B.animalis
Danone
B.lactis B6-12
Chr. Hansen
B.longum BB 536
Morinaga Milk Industry
B.longum SBT- 2928
Snow Brand Milk Products
B.breve
Yakult
Принципиальными их недостатками является неадаптированность использованных в них штаммов микроорганизмов для российской популяции людей, присутствие в их составе штаммов бактерий с потенциальной способностью вызывать в ослабленном организме гнойно-воспалительные процессы (например, энтерококков), высокая стоимость подобных препаратов, ограничивающая массовое лечебно-профилактическое их применение в современных экономических условиях нашей страны.
В России также разработаны и используются комплексные пробиотические препараты и продукты питания, в состав которых включены несколько штаммов различных микроорганизмов (Бификол, Ацилакт, Бифилонг, Полибактерин, Мульти 1-, 2, 3 и некоторые другие).
Штаммы бифидобактерий и лактобацилл, входящих в их состав, на протяжении десятилетий успешно использовались в пробиотических фармакопейных препаратах первого поколения и различных кисломолочных продуктах функционального назначения.
Они, как полагают, полностью безопасны для человека и имеют доказанные противоинфекционные, иммуностимулирующие, антиаллергенные, антистрессовые и другие позитивные эффекты, направленные на поддержание и восстановление здоровья.
При конструировании комплексных пробиотиков основываются на том, что каждый индивидуум, употребляя поликомпонентный пробиотический препарат, создает благоприятные условия для отбора из него представителей тех видов бифидо- и лактобацилл, которые в его кишечнике находятся в дефиците.
Антагонистические свойства пробиотических микроорганизмов, присутствующих в свежеприготовленной жидкой форме более выражены, чем у тех же штаммов, находящихся в лиофилизированном состоянии; это может быть связано с присутствием в жидких формах пробиотиков более высоких концентраций уксусной, молочной кислот, перекиси водорода, а возможно и других антагонистических и иных регуляторных субстанций-метаболитов [1].
Систематическое использование пробиотических препаратов, биологически активных добавок и продуктов питания повышает колонизационную резистентность, усиливает иммунитет, предотвращает развитие аллергических осложнений, нормализует пул гистамина и щавелевой кислоты, оказывает гипохолестеринемический противоопухолевый и другие положительные эффекты на человека.
Исходя из этого, создание пробиотиков и продуктов функционального питания на основе пробиотических штаммов микроорганизмов, обладающих специфическим позитивным действием на организм человека рассматривают как стратегическое направление альтернативной медицины, направленное на поддержание и восстановление здоровья человека [4; 6; 7; 9; 10].
К сожалению, с расширением спектра показаний для назначения пробиотиков стала накапливаться информация, что положительный эффект пробиотиков даже при длительном применении нередко носит транзиторный характер, а порой, к сожалению, и полностью отсутствует.
Более того, хотя безопасность использования пробиотических препаратов, добавок и продуктов питания является достаточно хорошо установленным фактом, появились отдельные сообщения о возникновении у лиц, длительно принимающих живые пробиотические микроорганизмы, различных осложнений (лакцидемии у грудных детей, аутоиммунные заболевания, аллергические проявления, оппортунистические инфекции, дисбиотические состояния, обусловенные назначением больших доз пробиотических препаратов и т.д.). [4; 10].
Одной из главных причин случаев неэффективности пробиотиков может быть чужеродность для человека входящих в их состав микроорганизмов, недостаточный учет высокой видовой, индивидуальной и анатомической специфичности автохтонной микрофлоры лиц, которым назначают эти средства коррекции микроэкологических нарушений.
В результате штаммы микроорганизмов, проявляющие in vitro или на экспериментальных животных пробиотическую активность, совершенно необязательно проявляют схожую активность на человеке как в объеме, так и в той экологической нише и по тому назначению, которые они должны были бы проявлять, исходя из существующих традиционных представлений.
Следует помнить, что многие вопросы взаимодействия между резидентными и пробиотическими микроорганизмами, между последними и клетками организма хозяина (quorum sensing) также еще ждут своего решения [8].
С целью повышения эффективности пробиотикотерапии и предотвращения возможного развития нежелательных осложнений на модели лактофлоры недавно обоснован принципиально новый подход к селекции пробиотических штаммов и лечебно-профилактическому их назначению.
В его основе лежит трансплантационный принцип совместимости входящих в них микроорганизмов с резидентной микрофлорой хозяина. Предлагается при выборе пробиотиков перед их назначением предварительно исследовать in vitro характер взаимоотношений (биосовместимость) входящих в них пробиотических штаммов микроорганизмов с индигенными лактобациллами будущего реципиента.
Разработан простой «инвитровый» прием определения биосовместимости резидентных и пробиотических лактобацилл, позволяющий с минимальными временными и экономическими затратами осуществлять подбор пробиотических средств и продуктов питания для индивидуализации бактериотерапии и бактериопрофилактики [2].
Микробная экология каждого человека представляет собой чрезвычайно сложную по составу экосистему на формирование которой потребовались многие миллионы лет эволюции. Поэтому, чрезвычайно трудно, а практически невозможно, разработать адекватные пробиотики для каждого индивидуума для поддержания нормальной микрофлоры на оптимальном уровне путем механического объединения отдельных чистых культур микроорганизмов.
Кроме того, как уже указывалось выше пробиотические микроорганизмы даже человеческого происхождения иммунологически несовместимы с реципиентом, которому они предназначены и вскоре после прекращения их назначения быстро элиминируются из организма.
Все это послужило основанием разработки концепции создания пробиотиков и продуктов функционального питания на основе аутоштаммов и аутоассоциаций симбиотических микроорганизмов.
В качестве источников подобных культур и их комплексов могут выступать криобанки нормальных микробиоценозов человека, в которых биологический материал (например содержимое толстой кишки) сохраняется бесконечно долго в условиях его хранения в жидком азоте.
В криобанке целесообразно сохранять микробиоценозы здоровых детей, женщин детеродного возраста и беременных, лиц, которые будут работать в экстремальных условиях или в условиях стресса (летчики, моряки, водители, журналисты, бизнесмены и т.д.), работников производств с вредными условиями труда (предприятия атомной, химической промышленности и т.д.), любых здоровых людей, желающих длительно сохранить свою нормальную микрофлору на случай возникновения у них микроэкологических нарушений в результате воздействия антибиотиков, радио- или противоопухолевой терапии и в других ситуациях для последующей имплантации им аутобиоматериала в случае необходимости.
Биоматериал, хранящийся в подобных криобанках, в последующем может быть использован для конструирования простых и сложных по составу аутопробиотиков и продуктов функционального питания, фармакологических препаратов и биологически активных соединений микробного происхождения, для направленного конструирования микробной экологии у новорожденных, аутотрансплантации взрослым реципиентам, для других исследований, связанных с микроэкологической инженерией [5, 11].
Несмотря на крайнюю перспективность пробиотические корректоры нормальной микрофлоры, приготовленные на основе аутофлоры, внедряются в практику крайне медленно.
Недавно за рубежом на рынок вышли генномодифициролванные пробиотики на основе Lactococcus lactis, в егном которых искусственно введены структурные гены эукариотических клеток, детерминирующие продукцию функциональных цитокинов (IL-10) и других регуляторных протеинов (TFF- фактор).
В экспериментах на животных и в клинических наблюдениях показана высокая эффективность подобного пробиотика в лечении болезни Крона и язвенного колита [12,13].
Только в США в 2010 году рынок пробиотических препаратов и продуктов питания составит 1,1 млрд $ США ( Суворов А.Н., 2005; выступление на Гастронеделе, г. Москва).
Во все больших масштабах для профилактики и коррекции микроэкологических нарушений в пищеварительном тракте в настоящее время используют, так называемые, пребиотики, селективно стимулирующие рост «хороших» микроорганизмов (прежде всего, бифидобактерий и лактобацилл)(табл.9), и как результат, улучшающие разнообразные физиологические функции и метаболические реакции, связанные с функционированием симбиотической микрофлоры (устойчивость к инфекциям снижение риска возникновения злокачественных новообразований в толстом кишечнике, улучшение биоусвояемости кальция и магния, колонизации кишечника грудных детей полезными микроорганизмами, снижение уровня сывороточного холестерина и т.д.).
Таблица 9. Основные виды пребиотических соединений
Группа
Ростстимулирующее вещество
Моносахариды, спирты
Ксилит, мелибиоза, ксилобиоза, раффиноза, сорбит и др.
Oлигосахариды
Лактулоза, лацитол, соевый олигосахарид, латитололигосахарид, фруктоолигосахарид, галактоолигосахарид, изомальтоолигосахарид, диксилоолигосахарид и др.
Полисахариды
Пектины, пуллулан, декстрин, инулин, хитозан и др.
Ферменты
b-микробные галактозидазы, протеазы сахаромицетов и др.
Пептиды
Соевые, молочные и др.
Аминокислоты
Валин, аргинин, глутаминовая кислота и др.
Антиоксиданты
Витамины А, С, Е, a-, b-каротины, другие каротиноиды, глутатион, убихинол, соли селена и др.
Ненасыщенные жирные кислоты
Эйкозопентаеновая кислота и др.
Органические кислоты
Пропионовая, уксусная, лимонная и др.
Растительные и микробные экстракты
Морковный, картофельный, кукурузный, рисовый, тыквенный, чесночный, дрожжевой и др.
Другие
Лецитин, парааминометилбензойная кислота, лизоцим, лактоферрин, глюконовая кислота, крахмальная патока и др.
Термин пребиотики был внедрен в научную литературу в начале 90-х годов. Среди пребиотиков наиболее популярны поли- и олигофруктаны, соевые олигосахариды, галактоолигосахариды, изолированные из природных источников или получаемые биотехнологическим или синтетическим методами.
Предполагается, что к 2010 году мировое производство подобных пребиотиков достигнет сотен тысяч тонн. Они реализуются самостоятельно, в виде обогащающих добавок к разнообразным продуктам питания, а также в комбинации с пробиотическими микроорганизмами (синбиотики) [4; 6-9; 15; 16].
Помимо перечисленных в качестве пребиотических субстанций используются также различные блокаторы адгезии и ингибиторы роста патогенных и оппортунистических микроорганизмов (лектины, антиадгезины, модуляторы синтеза секреторных иммуноглобулинов, дефензины различных типов, структурные компоненты пробиотических микроорганизмов, их метаболиты и т.д.).
Среди научно-практических направлений, связанных с микробной экологией, перспективными для разработки и реализации в Российской Федерации являются:
-Разработка экспрессных молекулярных методов исследования состава и активности микробиоценозов человека и животных;
-Поиски новых пребиотических функциональных субстанций;
- Исследование и детализация молекулярных, биохимических и иных механизмов эффективности пробиотиков, пребиотиков и симбиотиков в профилактике, лечении и увеличении сроков ремиссии при различных заболеваниях, ассоциированных с дисбалансом микробной экологии пищеварительного тракта;
-Углубленная оценка безопасности пробиотических препаратов и продуктов питания, используемых человеком;
- Исследования возможности использования представителей нормальной микрофлоры в качестве носителей при конструировании различного рода бактериальных и вирусных вакцин;
- Создание современных биотехнологических предприятий по производству пребиотиков, синбиотиков, стартерных заквасок прямого внесения, антибиотиков, иммуномодуляторов, витаминов, биогенно активных пептидов, биосенсоров и т.д. на основе представителей нормальной анаэробной микрофлоры человека и животных.
Назрела необходимость создания в стране межотраслевой научной Программы «Микробная экология человека и животных: фундаментальные и прикладные аспекты».
Не вызывает сомнения, что научно-обоснованное использование пробиотиков, пребиотиков, синбиотиков и продуктов функционального питания на их основе является важным приемом сохранения и восстановления здоровья.
Следует надеяться, что и в ХХI веке микроэкологические подходы сохранят достойное место среди современных технологий профилактической и восстановительной медицины.
Литература.
1.Глушанова Н.А., О биологической и антагонистической активности «сухохо» и «жидкого» пробиотика «Narine» // Бюллетень Восточно-Сибирского НЦ СО РАМН, 2005, №1, 130-133.
2.Глушанова Н.А., Б.А.Шендеров. Взаимоотношения пробиотических и индигенных лактобацилл хозяина в условиях совместного культивирования in vitro// Журнал. Микробиол. 1005. № 2, 75-79
3.Шендеров Б.А. Медицинская микробная экология и функциональное питание. Т.1, 287 с.; Т2, 413с. М. 1998. Изд-во Грантъ.
4.Шендеров Б.А. Медицинская микробная экология и функциональное питание. Т.3. Пробиотики и функциональное питание. М. 2001. Изд-во Грантъ, 287 с.
5.Шендеров Б.А. Функциональное питание, криогенные банки микробиоценозов и их роль в сохранении и восстановлении здоровья //Вестник восстановительной медицины.2003, №1,29-31
6Holm F. Gut Health and diet// World Food Ingredient. 2003, February, 52-55
7.Holzapfel W.H., Shillinger U. Introduction to pre- and probiotics.// Food Research International. 2002, v.35, 109-116
8.Lenoir-Wiujnkoop I., M.Hopkins. The Intestinal Microflora. Understanding the Symbiosis. Danone Vitapole. John Libbey Eurotext. 2003, 48 p.
9.Mattila-Sandholm T., Saarela M., L. Lahteeenmaki. Gut Health Foods// World Food Ingredient. 2004, February, 5052-55
10.Saarela M., Lahteenmaki, Crittenden, Salminen S., T. Mattila-Sandholm. Gut bacteria and Health foods-the European perspective.// International J. Food Microbiology, 2002, v.78, 99-117
11.Shenderov B.A., Manvelova M.A., Gahova E.N., D.A. Piorunski. Functional Food and Cryobanks of Microbiocenoses-Practical Applications of Gnotobiology in the 21st Centure. // Germfree Life and its Ramifications (K.Hashimoto et al. eds), Shiozawa, Japan, 1996, 533-536
12.Steidler L., Neirynck S., Vandenbroucke K. et al. Genetically Modified Lactococcus: Novel Tools for Medicine// The XVth International Symposium on Gnotobiology, June 20-24, 2005. Tokyo, Japan, 48
13.Vandenbroucke K., Hans W., Van Huysse J. et al. Active delivery of trefoil factors by genetically modified Lactococcus lactic prevents and heals acute colitis in mice// Gastroenterology, 2004, v.127, 502-513
14. Wyers R. Prebiotics Research// World Food Ingredient. 2003, December, 58-59
15. Wyers R. Spreading Probiotics // World Food Ingredient. 2004, March, 26-27
16. Wyers R. Prebiotics in Action// World Food Ingredient. 2004, October/November, 74-77
В начало статьи.Часть 1...
Источник: https://disbak.ru/nauchnye-publikatsii/sovremennoe-sostoyanie-i-perspektivy-razvitiya-kontseptsii-probiotiki-prebiotiki-i-sinbiotiki-chast-2.html
© ГастроПорта