4.Методы определения чувствительности микроорганизмов к антибактериальным препаратам
4.1. Общая характеристика методов.
Современные стандартизованные методы определения чувствительности микроорганизмов к АБП подразделяют на методы серийных разведений и диффузионные.
Методы серийных разведений основаны на прямом определении основного количественного показателя, характеризующего микробиологическую активность АБП - величины его минимальной подавляющей концентрации (МПК).
МПК – минимальная концентрация, подавляющая видимый рост исследуемого микроорганизма в бульонной культуре или на плотной среде.
Для определения МПК заданные концентрации АБП вносят в питательную среду, которую затем засевают культурой исследуемого микроорганизма, и после инкубации оценивают наличие или отсутствие видимого роста.
В зависимости от характера используемой питательной среды различают методы серийных разведений в агаре или в бульоне. В зависимости от объема используемой жидкой питательной среды выделяют методы серийных макро - и микроразведений.
Разновидностью метода серийных разведений является также метод, основанный на использовании только двух концентраций АБП, соответствующих пограничным значениям МПК (см. ниже). Этот принцип исследования широко используется в автоматизированных системах для определения чувствительности микроорганизмов.
Диффузионные методы определения чувствительности основаны на диффузии АБП из носителя в плотную питательную среду и подавлении роста исследуемой культуры в той зоне, где концентрация АБП превосходит МПК.
В настоящее время существуют две основные модификации диффузионного метода: диско-диффузионный и Е-тест.
В диско-диффузионном методе в качестве носителя АБП используют бумажный диск. Образование зоны подавления роста происходит в результате диффузии АБП из носителя в питательную среду. В определенных пределах величина диаметра зоны подавления роста обратно пропорциональна МПК. Однако диско-диффузионный метод позволяет лишь косвенно судить о величине МПК, а результатом исследования является отнесение микроорганизма к одной из категорий чувствительности (чувствительный, промежуточный или резистентный).
Е-тест представляет собой узкую полоску полимера, (0,5 х 6,0 см), на которую нанесен градиент концентраций АБП (от минимальных до максимальных). Подавление роста микроорганизма вокруг полоски Е-теста происходит только в той зоне, где концентрация АБП, диффундирующего из носителя, выше МПК, при этом образуется каплевидная зона ингибиции. Значения концентрации АБП в каждом участке носителя типографским способом нанесены на наружной (обращенной к исследователю) поверхности Е-теста. Величину МПК учитывают в том месте, где граница зоны подавления роста вплотную подходит к носителю. Детальные инструкции по определению чувствительности с использованием Е-тестов прилагаются изготовителем к набору реактивов.
4.1.1. Основные этапы проведения тестирования.
Оценка антибиотикочувствительности независимо от конкретного метода предполагает последовательное выполнение нескольких этапов:
- приготовление питательных сред;
- приготовление суспензии исследуемых микроорганизмов (инокулюма);
- инокуляция;
- инкубация;
- учет и интерпретация результатов, формулировка рекомендаций по лечению.
Диффузионные методы включают также этап наложения дисков или полосок Е-теста на плотную питательную среду.
4.1.2. Приготовление питательных сред для определения чувствительности.
Для оценки чувствительности используют специально предназначенные для этой цели среды, разрешенные к применению в Российской Федерации в установленном порядке и по своим характеристикам удовлетворяющие требованиям, приведенным в разделе 5. Внутрилабораторный контроль качества среды проводят при использовании всех сред, разрешенных к применению в Российской Федерации в установленном порядке.
Вид питательной среды для оценки чувствительности определяют выбранным методом проведения исследования (агар или бульон), а также видом тестируемого микроорганизма.
Выбранную питательную среду для определения чувствительности готовят из сухой среды промышленного производства в соответствии с инструкцией изготовителя. После автоклавирования питательную среду сразу же разливают в стерильные пробирки или в чашки Петри, или (если необходимо) колбы со средой помещают на водяную баню при 48–500С, где выдерживают до достижения указанной температуры, после чего в них асептически вносят термолабильные питательные добавки и/или рабочие растворы антибиотиков, а затем разливают в пробирки или в чашки Петри.
Агар разливают по чашкам слоем толщиной 4 мм (на чашку диаметром 100 мм требуется 25 мл агара, на чашку диаметром 90 мм - 20 мл). Чашки оставляют при комнатной температуре для застывания. Приготовленные указанным образом чашки Петри предпочтительнее использовать немедленно. Допускается хранение в запаянных полиэтиленовых пакетах в холодильнике при +4 – +80С в течение 5 суток.
4.1.3. Приготовление суспензии исследуемых микроорганизмов (инокулюма).
Общим и принципиально важным для всех методов тестирования является стандартизация суспензии исследуемого микроорганизма, ее концентрация должна составлять 1,5´108 КОЕ/мл. Практически наиболее приемлемым методом оценки концентрации бактериальной суспензии является измерение ее оптической плотности. Оптическая плотность бактериальной суспензии с концентрацией 1,5´108 КОЕ/мл при визуальном контроле соответствует стандарту мутности 0,5 по МакФарланду. Контроль оптической плотности суспензии можно также осуществлять спектрофотометрически (денситометрически). Существуют коммерчески доступные стандарты мутности и спектрофотометры. Бактериальную суспензию можно готовить либо из бульонной, либо из агаровой культуры.
Приготовление инокулюма из агаровой культуры.
Для приготовления инокулюма используют чистую суточную культуру микроорганизмов, выросших на плотных питательных средах. Отбирают несколько однотипных, четко изолированных колоний, выросших на неселективных плотных питательных средах. Петлей переносят незначительное количество материала с верхушек колоний в пробирку со стерильным физиологическим раствором или питательным бульоном, доводя плотность инокулюма точно до 0,5 по стандарту МакФарланда. Инокулюм следует использовать в течение 15 минут после приготовления.
Приготовление инокулюма из бульонной культуры.
При определении чувствительности быстро растущих бактерий с обычными питательными потребностями для приготовления инокулюма также можно использовать 5-6 часовую бульонную культуру микроорганизма. Для этого отбирают несколько однотипных изолированных колоний, петлей переносят незначительное количество материала в пробирку с 4,0–5,0 мл жидкой неселективной питательной среды. Инкубируют при 350С. Примерно через 5-6 ч инкубации плотность микробной суспензии приблизительно соответствует необходимой, и ее точно доводят до 0,5 по МакФарланду путем добавления стерильного бульона или физиологического раствора.
Стандарт МакФарланда может быть либо приобретен, либо приготовлен в лаборатории.
4.1.4. Приготовление стандарта 0,5 по МакФарланду.
К 0,5 мл раствора BaCl2 в концентрации 0,048 моль/л (1,175% раствор BaCl2 x 2 H2O) медленно при тщательном перемешивании добавить 99,5 мл раствора H2SO4 в концентрации 0,18 моль/л (1%) до получения гомогенной суспензии.
Правильность приготовления суспензии необходимо проверить на спектрофотометре. Поглощение при использовании кюветы 1 см должно составить 0,08 – 0,10 при длине волны 625 нм.
Полученную суспензию необходимо разлить по 4–6 мл в пробирки с герметично закрывающимися крышками. Пробирки должны быть такого же диаметра, как и используемые для приготовления бактериальной суспензии.
Хранить пробирки с суспензией необходимо в темноте при комнатной температуре.
Перед использованием пробирки необходимо тщательно встряхивать и оценивать однородность суспензии. При появлении видимых частиц пробирки изымаются из употребления.
Стандарт мутности необходимо обновлять или проверять его оптическую плотность ежемесячно.
4.2. Методы серийных разведений.
4.2.1. Приготовление растворов АБП для методов серийных разведений.
Общим и крайне важным этапом для всех методов серийных разведений является приготовление растворов АБП. Различают «основные» растворы АБП (пригодные для хранения) и «рабочие» - те, которые необходимо использовать "ex tempore" для приготовления питательных сред.
Для приготовления основных растворов АБП необходимо использовать субстанции АБП с известной активностью, лекарственные формы не пригодны. Для взвешивания субстанций необходимо использовать электронные лабораторные весы с точностью до 4 знака, для измерения объёмов – калиброванные дозаторы и пипетки.
Основные растворы АБП готовят в концентрации 1000,0 мкг/мл и выше. Навески АБП для приготовления базовых растворов готовят с учетом их активности. Расчет навески АБП для приготовления базового раствора проводят по формуле:
- m АБ теор. – расчётная (теоретическая) навеска АБП;
- С – необходимая концентрация АБП;
- V теор. – объём растворителя для растворения теоретической навески;
- А – активность АБП (количество активного вещества, содержащегося в субстанции)
Взвесить точно расчётное количество порошка практически невозможно. Поэтому готовят близкую к расчётной навеску, а затем пересчитывают количество необходимого растворителя.
- V практ. – объём растворителя для растворения практической навески;
- m АБ практ. –полученная навеска АБП;
- m АБ теор. – расчётная (теоретическая) навеска АБП;
- V теор. – объём растворителя для растворения теоретической навески;
В связи с тем, что АБП существенно различаются по растворимости, в ряде случаев возникает необходимость использовать различные вещества для первичного растворения (солюбилизации) препаратов (растворители) и для доведения их до заданной концентрации (разбавители). В тех случаях, когда растворители и разбавители являются разными веществами, для растворения АБП необходимо использовать минимально возможное количество растворителя.
Отличные от воды растворители и разбавители для отдельных АБП приведены в таблице 1. Основные растворы необходимо хранить при температуре не выше –200С (сроки хранения отдельных АБП при этой температуре существенно различаются). Оптимальными условиями для хранения основных растворов АБП является температура –600С и ниже, длительность не более 6 месяцев. При этом необходимо иметь в виду, что основные растворы бета-лактамных АБП могут терять активность и в более ранние сроки.
После извлечения из холодильника перед открыванием флаконов с основными растворами их необходимо довести до комнатной температуры для предотвращения конденсации влаги. Размороженные основные растворы должны быть использованы для приготовления рабочих растворов, повторное замораживание не допускается. Для приготовления рабочих растворов используется дистиллированная вода.
Из рабочих растворов готовят двукратные разведения АБП. При расчетах за основу берется конечная концентрация АБП в питательной среде равная 1,0 мкг/мл (более высокие - 2, 4, 8, и т.д.; более низкие – 0,5; 0,25; 0,125 и т.д.). При этом реальные концентрации растворов должны учитывать фактор разбавления раствора АБП при приготовлении чашек с плотной питательной средой или при инокуляции. Диапазон двукратных серийных разведений АБП зависит от вида тестируемого микроорганизма, предполагаемой активности АБП и целей исследования.
4.2.2. Метод серийных разведений в бульоне.
Различают два основных варианта метода серийных разведений в бульоне: макрометод (пробирочный) и микрометод (при величине конечного объема 0,2 мл и меньше). Область применения макрометода из-за низкой производительности ограничивается случаями необходимости оценки чувствительности единичных штаммов.
Макрометод.
Процедура.
Тестирование проводят в объеме 1 мл каждого разведения АБП с конечной концентрацией исследуемого микроорганизма примерно 5 x 105 КОЕ/мл.
Питательная среда.
Питательный бульон для определения чувствительности разливают по 0,5 мл в каждую пробирку. Количество пробирок определяют необходимым диапазоном разведений АБП и увеличивают на одну для постановки "отрицательного" контроля.
Приготовление серийных разведений АБП (рис. 1).
Рабочий раствор АБП готовят из основного раствора с использованием жидкой питательной среды. Концентрацию рабочего раствора рассчитывают исходя из необходимой максимальной концентрации в ряду серийных разведений, учитывая фактор разбавления препарата при последующей инокуляции. Затем рабочий раствор в количестве 0,5 мл при помощи микропипетки со стерильным наконечником вносят в первую пробирку, содержащую 0,5 мл бульона. Тщательно перемешивают и новым стерильным наконечником переносят 0,5 мл раствора АБП в бульоне во вторую пробирку, содержавшую первоначально 0,5 мл бульона. Эту процедуру повторяют, пока не будет приготовлен весь необходимый ряд разведений. Из последней пробирки 0,5 мл бульона удаляют.
Таким образом, получают ряд пробирок с растворами АБП, концентрации которых отличаются в соседних пробирках в 2 раза. Одновременно готовят дополнительные ряды серийных разведений АБП для тестирования контрольных штаммов. Серия разведений обязательно должна включать в себя пограничные концентрации и допустимые диапазоны МПК для контрольных штаммов.
Приготовление инокулюма и инокуляция.
Для инокуляции используют стандартную микробную взвесь, эквивалентную 0,5 по стандарту МакФарланда, разведенную в 100 раз на питательном бульоне, после чего концентрация микроорганизма в ней составит примерно 106 КОЕ/мл.
По 0,5 мл инокулюма вносят в каждую пробирку, содержащую по 0,5 мл соответствующего разведения АБП, и в одну пробирку с 0,5 мл питательного бульона без антибиотика ("отрицательный" контроль). Конечная концентрация микроорганизма в каждой пробирке достигнет необходимой - примерно 5 x 105 КОЕ/мл. Инокулюм должен быть внесен в пробирки с разведениями АБП не позднее 15-30 мин. с момента приготовления.
Инкубация.
Пробирки закрывают стерильными ватно-марлевыми пробками или металлическим колпачками, и все пробирки с тестируемыми штаммами, кроме пробирки "отрицательный" контроль, инкубируют в обычной атмосфере при температуре 35оС в течение 16-20 или 20-24 ч (в зависимости от вида тестируемого микроорганизма). Пробирку "отрицательный" контроль помещают в холодильник при +4оС, где хранят до учета результатов.
Учет результатов.
Для определения наличия роста микроорганизма пробирки с посевами просматривают в проходящем свете. Рост культуры в присутствии АБП сравнивают с референтной пробиркой ("отрицательный" контроль), содержащей исходный инокулюм и хранившейся в холодильнике. МПК определяют по наименьшей концентрации АБП, которая подавляет видимый рост микроорганизма.
Микрометод.
Преимуществами микрометода является высокая производительность и возможность длительного хранения заранее приготовленных планшет. Тестирование проводят при величине конечного объема 0,2 мл и меньше, что позволяет значительно сократить количество расходных материалов. Методика не имеет отличий от макрометода, за исключением используемых объемов питательного бульона с разведениями антибиотиков и инокулюма, но требует дополнительного оснащения лаборатории многоканальными пипетками, 96-луночными планшетами для иммунологических исследований (с плоским дном) со стерильными крышками.
Первым этапом является изготовление планшет, пригодных для хранения. После внесения рабочих растворов антибиотиков в лунки, запаянные в полиэтилен планшеты могут храниться при температуре ниже –600С до момента использования. Повторное замораживание-оттаивание не допускается.
Для проведения исследования планшеты после извлечения из холодильника выдерживают до достижения ими комнатной температуры, после чего проводят инокуляцию приготовленной суспензией исследуемого микроорганизма. При проведении инкубации планшет обязательно должен быть закрыт крышкой для предотвращения высыхания содержимого лунок.
Учет результатов проводят визуально или спектрофотометрически, сравнивая рост микроорганизма в присутствии АБП с ростом культуры в ячейке без АБП. За МПК принимают минимальную концентрацию, обеспечивающую полное подавление видимого роста исследуемого штамма.
Метод серийных микроразведений в бульоне легко поддается модификациям для разработки тест-систем. При использовании тест-систем, разрешенных к применению в Российской Федерации в установленном порядке, следует пользоваться инструкциями изготовителей.
Контроль качества.
При постановке методов серийных разведений в бульоне необходимо проводить контроль роста культуры в среде без АБП. Необходимо также контролировать чистоту суспензии микроорганизма, использованной для инокуляции, путем высева на неселективные среды. Каждая партия тестируемых штаммов сопровождается внутренним контролем качества исследования с использованием соответствующих контрольных (референтных) штаммов.
4.2.3. Метод серийных разведений в агаре.
Метод серийных разведений в агаре позволяет одновременно определить МПК партии штаммов (от 15 до 30 клинических штаммов + контрольные штаммы,
в зависимости от используемой модели инокулятора).
Процедура.
Принцип метода заключается в посеве тестируемых микроорганизмов на чашки Петри с агаром, содержащим последовательные двойные разведения антибиотиков. Одновременно проводят тестирование партии клинических штаммов и соответствующих контрольных штаммов, а также контроль роста микроорганизмов на чашках без АБП и контроль чистоты культуры путем высева образцов инокулюма на неселективные питательные среды.
Приготовление серийных разведений АБП.
Из основного раствора исследуемого АБП готовят рабочий раствор в концентрации в 10 раз превосходящей максимальную из используемых в конкретном исследовании. Затем готовят серию двукратных разведений рабочего раствора. Таким образом, концентрация в АБП в каждом последующем разведении должна быть в 2 раза меньшей, чем в предыдущем. Для приготовления серии разведений используют любые стерильные химически инертные лабораторные ёмкости с завинчивающимися крышками объёмом не менее 10 мл (для удобства размешивания).
Питательная среда.
Сухую агаризованную питательную среду растворяют и автоклавируют в соответствии с инструкцией изготовителя. После автоклавирования колбы с питательной средой помещают на водяную баню при 48 - 500С, где выдерживают до достижения указанной температуры, после чего в них асептически вносят рабочие растворы антибиотиков (1 часть рабочего раствора АБП на 9 частей расплавленного агара) и, при необходимости, термолабильные питательные добавки. Затем среду тщательно перемешивают и разливают по чашкам Петри, толщина слоя питательной среды должна быть 3-4 мм.
Вторым способом приготовления чашек Петри с агаром, содержащим разведения АБП, является смешивание питательной среды и раствора АБП непосредственно в чашке Петри. Для приготовления стандартных пластиковых чашек диаметром 90 мм необходимо к 2 мл раствора АБП добавить 18 мл разогретого до 50оС жидкого агара. Чашки предварительно маркируют с указанием препарата и его концентрации. Очень важно тщательно перемешивать агар до того, как он начнёт застывать для равномерного распределения АБП по всей толще питательной среды. Перемешивание производят на горизонтальной поверхности последовательно плавными разнонаправленными круговыми движениями чашки. После приготовления чашек агар должен затвердеть в горизонтальном положении. Нельзя резко передвигать, переносить чашки до полного застывания агара.
Параллельно с чашками Петри, содержащими растворы антибиотиков, для контроля роста готовят чашки Петри без антибиотиков. Чашки оставляют при комнатной температуре для застывания и подсушивания на 10-12 ч.
Приготовленные указанным образом чашки Петри предпочтительнее использовать немедленно, однако допускается хранение в запаянных полиэтиленовых пакетах при +4–+80С в течение 5 сут. При этом необходимо иметь в виду, что некоторые бета-лактамные антибиотики (прежде всего, ампициллин, цефаклор, имипенем), особенно при низких концентрациях не выдерживают даже указанный срок хранения. В этой связи стабильность антибиотиков в приготовленных в лаборатории чашках Петри целесообразно устанавливать экспериментально с использованием референтных штаммов.
Приготовление инокулюма и инокуляция.
Конечная посевная доза исследуемого микроорганизма на поверхности питательной среды должна составлять 104 КОЕ. Поскольку коммерческие инокуляторы или стандартная бактериологическая петля диаметром 3,0 мм переносят 1-2 мкл жидкости, концентрация микроорганизмов в исходной суспензии должна быть 107 КОЕ/мл. Такую концентрацию можно получить при разведении стандартной микробной суспензии, соответствующей стандарту 0,5 по МакФарланду, в 10 раз. Полученную суспензию необходимо инокулировать на поверхность агара в течение 15 мин после приготовления, при этом образуется пятно диаметром 5-8 мм.
Для контроля качества приготовления суспензий периодически рекомендуется проводить подсчет реальных колониеобразующих единиц путем высева образца приготовленного инокулюма на неселективные питательные среды.
Инкубация.
После инокуляции чашки оставляют при комнатной температуре для подсыхания, далее переворачивают и инкубируют при температуре 35оС в течение 18-24 ч (в зависимости от вида тестируемого микроорганизма).
Учет результатов.
Учет результатов проводят, поместив чашку на темную не отражающую свет поверхность. За МПК принимают концентрацию, вызвавшую полную ингибицию видимого роста. Для дифференцировки нежного роста от налета, оставшегося после инокулята, в ряде случаев целесообразно использовать увеличение. Появление единственной колонии на чашке с концентрацией на 1 разведение выше, чем явная МПК, можно не учитывать. Результат оценки антибиотикочувствительности имеет смысл учитывать только при подтверждении чистоты культуры (см. контроль качества).
Контроль качества
При постановке методов серийных разведений в агаре необходимо проводить контроль роста культуры на чашке Петри с питательной средой, не содержащей АБП. Важнейшим требованием контроля качества является высев, использованной для инокуляции суспензии на плотную неселективную среду для подтверждения чистоты культуры! Каждая партия тестируемых штаммов сопровождается внутренним контролем качества исследования с использованием соответствующих контрольных (референтных) штаммов.
4.2.4. Общие замечания по методам серийных разведений.
Несмотря на то, что методы серийных разведений являются наиболее точными и информативными, их постановка в практических лабораториях сопряжена со значительными методическим трудностями. Прежде всего речь идет о необходимости использования субстанций антибиотиков с известным уровнем активности, строгого соблюдения режимов хранения, тщательного выполнения контроля качества питательных сред, трудоемкости приготовления рабочих растворов антибиотиков.
Использование тест-систем на основе метода микроразведений позволяет избегать трудоемких процедур по стандартизации подготовительных этапов, но при этом обеспечивает получение достоверных количественных результатов по уровню антибиотикорезистентности. Весьма экономичным и простым в исполнении является также вариант метода серийных микроразведений, основанный на использовании двух пороговых концентраций, позволяющий получить качественные результаты (т.е. распределить штаммы по чувствительности на три категории).
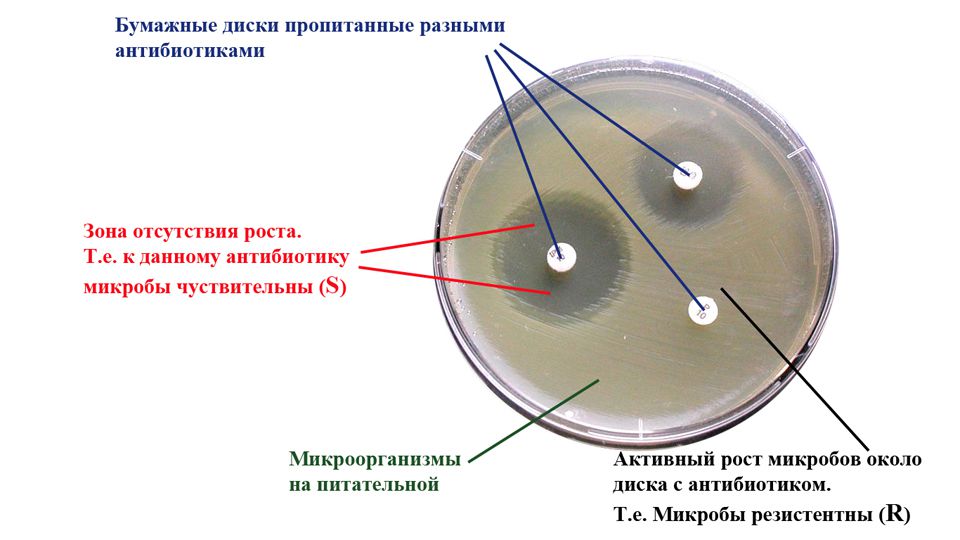
4.3. Диско-диффузионный метод (ДДМ).
Принцип метода.
ДДМ определения чувствительности основан на способности АБП диффундировать из пропитанных ими бумажных дисков в питательную среду, угнетая рост микроорганизмов, посеянных на поверхности агара.
Питательная среда.
Для определения чувствительности ДДМ используют такую же, как и для метода разведений в агаре, питательную среду. К качеству питательных сред для постановки диско-диффузионного метода выдвигают те же требования, что и к плотным питательным средам для постановки метода серийных разведений в агаре, соответственно используют и те же методы контроля качества.
Приготовление чашек Петри с плотной питательной средой связано с некоторыми особенностями. Плотную питательную среду готовят в соответствии с инструкцией изготовителя. Важным моментом при определении чувствительности ДДМ является толщина слоя агара в чашке. Она должна составлять 4,0±0,5 мм, что достигается при внесении в чашку Петри диаметром 90 мм строго 20 мл агара, диаметром 100 мм – 25 мл агара, а диаметром 150 мм – 60 мл агара. Перед заполнением расплавленной средой чашки Петри устанавливают на строго горизонтальную поверхность (выверенную по уровню, без впадин и выпуклостей). Соблюдение указанных предосторожностей необходимо в связи с тем, что размер и форма зоны ингибиции роста зависят от глубины и равномерности агарового слоя.
После заполнения чашки оставляют при комнатной температуре для застывания. Хранить чашки можно запаянными в полиэтиленовые пакеты при +4 – +80С, в течение
7-10 сут. При использовании свежеприготовленных чашек или чашек после хранения в холодильнике их необходимо подсушить перед инокуляцией, что достигается инкубацией при 350 С с приоткрытой крышкой в течение 10-20 мин. Перед инокуляцией необходимо проконтролировать отсутствие конденсата жидкости на внутренней поверхности крышек.
Диски с антибиотиками.
Для определения чувствительности ДДМ следует использовать только стандартизированные качественные диски. Изготовление дисков с АБП, необходимых для определения чувствительности диско-диффузионным методом, в лабораторных условиях нецелесообразно. Это связано с жесткими требованиями к исходным материалам (субстанциям АБП, картону) и со значительной трудоемкостью методов контроля качества дисков.
Для получения правильных результатов определения чувствительности ДДМ необходимо строго соблюдать правила хранения и использования коммерческих дисков, в противном случае содержание в них антибиотиков может снизиться ниже допустимого уровня (прежде всего в результате увлажнения) еще до истечения срока годности.
Долговременное хранение дисков с АБП осуществляют в герметичной упаковке в морозильной камере при температуре –18оС и ниже. Небольшие партии дисков, используемые при повседневной работе, можно хранить в холодильнике при температуре +4 – +80С, плотно укупоренными так, чтобы гарантировать невозможность попадания во флакон влаги, кроме того для дополнительной защиты от влаги во флаконах (картриджах) с дисками содержится специальный влагопоглотитель (силикагель).
Флаконы (картриджи) с дисками следует извлекать из холодильника за 1 ч до начала работы и выдерживать герметично закрытыми до достижения ими комнатной температуры, что предотвращает образование конденсата на дисках после открывания флаконов.
Приготовление бактериальной суспензии и инокуляция.
При определении чувствительности ДДМ используют стандартный инокулюм, соответствующий по плотности 0,5 по стандарту МакФарланда и содержащий примерно 1,5х108 КОЕ/мл. Инокулюм следует использовать в течение 15 минут после приготовления. Для инокуляции приготовленных чашек с агаром можно использовать два способа.
- Наиболее удобным способом инокуляции является использование стерильных ватных тампонов. Тампон необходимо погрузить в стандартную суспензию микроорганизма, затем избыток инокулюма удалить, отжав тампон о стенки пробирки. Инокуляцию проводят штриховыми движениями в трех направлениях, поворачивая чашку Петри на 600.
- При использовании второго способа стандартный инокулюм наносят пипеткой на поверхность чашки Петри с питательной средой в объеме
1-2 мл, равномерно распределяют по поверхности покачиванием, после чего удаляют избыток инокулюма пипеткой. Приоткрытые чашки подсушивают при комнатной температуре в течение 10-15 мин.
Аппликация дисков и инкубация.
Не позднее, чем через 15 мин после инокуляции на поверхность питательной среды наносят диски с АБП. Аппликацию дисков проводят с помощью стерильного пинцета или автоматического диспенсера. Расстояние от диска до края чашки и между дисками должно быть 15-20 мм. Таким образом, на одну чашку диаметром 100 мм следует помещать не более 6 дисков с АБП. Диски должны равномерно контактировать с поверхностью агара, для чего их следует аккуратно прижать пинцетом.
Непосредственно после аппликации дисков чашки Петри помещают в термостат кверху дном и инкубируют при температуре 35оС в течение 18-24 ч (в зависимости от вида тестируемого микроорганизма). Увеличение интервала времени между нанесением дисков на поверхность среды и началом инкубации (а соответственно – началом роста исследуемой культуры микроорганизма) приводит к "преддиффузии" АБП в агар и к увеличению диаметра зоны подавления роста.
Учет результатов.
После окончания инкубации чашки помещают кверху дном на темную матовую поверхность так, чтобы свет падал на них под углом в 450 (учет в отраженном свете). Диаметр зон задержки роста измеряют с точностью до 1 мм, предпочтительнее пользоваться штангенциркулем или кронциркулем.
При измерении зон задержки роста следует ориентироваться на зону полного подавления видимого роста. Не следует обращать внимания на очень мелкие колонии, выявляемые в пределах зоны задержки роста только при особых условиях освещения или увеличении, и едва заметный налет у края зоны. Исключение составляют случаи учета результатов определения чувствительности стафилококков к оксациллину, когда необходимо учитывать и самые мелкие колонии, выявляемые в пределах четкой зоны подавления роста.
Крупные колонии, выявляемые в пределах четкой зоны подавления роста, свидетельствуют о наличии посторонней микрофлоры или о гетерорезистентности популяции микроорганизмов, в этом случае необходимо повторить идентификацию микроорганизма, формирующего эту колонию, и определение чувствительности этого штамма.
При определении чувствительности ДДМ роящихся штаммов протея, зона подавления роста может быть затянута тонкой вуалеобразной пленкой, которая не мешает установлению границы зоны и не учитывается при регистрации результатов.
При определении чувствительности к сульфаниламидам и их комбинации с триметопримом границу зоны подавления роста следует учитывать на уровне ингибиции роста на 80%. Это связано с тем, что под действием этих препаратов перед полным подавлением роста возможно завершение 1-2 циклов пролиферации микроорганизма.
5. Контроль качества определения чувствительности
При определении чувствительности микроорганизмов к АБП любым методом необходимо выполнять процедуры внутреннего контроля качества исследования.
Достоверность результатов исследования чувствительности микроорганизмов к АБП зависит от следующих основных параметров:
- состава питательной среды;
- соответствия реальной активности используемых антибиотиков
(или их содержания в дисках) паспортным характеристикам (активности); - соблюдения стандартности выполнения всех лабораторных процедур.
5.1. Контроль чистоты роста культуры.
Образец инокулюма, использованного для оценки чувствительности, необходимо засеять на чашку с неселективной питательной средой и инкубировать в течение ночи. При выявлении на неселективной среде смешанной культуры результаты оценки антибиотикочувствительности не учитывают, исследование необходимо повторить.
5.2. Контроль качества питательных сред.
Контроль роста.
Каждую партию плотных питательных сред для определения чувствительности должны проверять на пригодность для роста тестируемых микроорганизмов. Для этого используют соответствующие контрольные штаммы E.coli, P.aeruginosa, S.aureus, E.faecalis, S.pneumoniae, H.influenzae, N.gonorrhoeae. Из суточных культур указанных микроорганизмов готовят микробную взвесь, соответствующую по плотности 0,5 по стандарту МакФарланда (содержащую приблизительно 1,5х108 КОЕ/мл). Из полученной микробной взвеси готовят серию последовательных разведений 1:10. Затем на приготовленные чашки с соответствующим агаром высевают по 0,1 мл взвеси -5, -6, -7 разведений, содержащих соответственно 1х103, 1х102, 1х101 КОЕ/мл. При хороших питательных свойствах среды должен отмечаться рост микроорганизмов из -6, -7 разведений.
Для контроля роста при определении чувствительности методами разведений
(в агаре, в жидкой питательной среде) используют чашки с агаром, пробирки с бульоном, или специально выделенные лунки микротитровального планшета, в которые не внесен АБП.
Контроль стерильности.
Для контроля стерильности проводят инкубацию при 35оС в течение 24 или более часов репрезентативного количества чашек с агаром из каждой партии при определении чувствительности ДДМ, чашек с агаром или пробирок с бульоном, не содержащих антибиотиков, при тестировании методом разведений в агаре или макроразведений в бульоне, соответственно. При определении чувствительности методом микроразведений контроль стерильности производят по специально выделенным для этой цели лункам микротитровального планшета, в которые не вносят растворы антибиотиков и микробную взвесь.
Проверка рН агара.
В условиях рутинной работы лаборатории допустимо не контролировать рН приготовленного агара, если результаты тестирования контрольных штаммов находятся в необходимых границах. При возникновении проблем с результатами тестирования контрольных штаммов, особенно к АБП, активность которых может существенно изменяться под влиянием рН питательной среды (например, аминогликозиды, макролиды, тетрациклины и др.), необходимо провести определение рН среды после автоклавирования, внесения всех необходимых добавок и охлаждения до комнатной температуры (250С). Для достоверного определения рН необходимо использовать рН-метр с поверхностно-активным электродом, другие методы определения рН (с помощью лакмусовой бумаги, обычного рН-метра) не должны использоваться, так как не обеспечивают получения достаточно точных результатов. Приемлемый диапазон рН для питательных сред для определения чувствительности 7,2 – 7,4. При рН среды, выходящей за указанные пределы, возможны существенные отклонения результатов определения чувствительности от должных значений.
Контроль катионного состава.
Для получения воспроизводимых результатов определения чувствительности к АБП (особенно к аминогликозидам, фторхинолонам, карбапенемам, тетрациклинам и некоторым другим) питательная среда должна содержать строго стандартизированные концентрации двухвалентных катионов, прежде всего Са2+ и Mg2+ (Са2+ = 20-25 мг/л и Mg2+ = 10-12,5 мг/л). Применение метода атомной абсорбционной спектрофотометрии для непосредственной оценки концентрации двухвалентных катионов в среде в повседневной практике мало реально.
О содержании в среде двухвалентных катионов косвенно можно судить по результатам тестирования чувствительности контрольного штамма Pseudomonas aeruginosa к аминогликозидам (диаметр зоны вокруг диска с гентамицином должен быть в пределах 16-21 мм, а МПК гентамицина – в пределах 0,5-2,0 мкг/мл).
Контроль содержания тимина и тимидина.
При определении чувствительности к АБП из группы антагонистов фолиевой кислоты (антифолатов) – сульфаниламидов и триметоприма – критически важным показателем является содержание антагонистов действия этих препаратов – тимина и тимидина в питательной среде. Питательные среды для определения чувствительности к сульфаниламидам и триметоприму должны содержать минимальные концентрации тимидина. О пригодности питательной среды для определения чувствительности к антифолатам можно косвенно судить по результатам тестирования контрольного штамма Enterococcus faecalis. Среда считается удовлетворительной по качеству при МПК триметоприма/сульфаметоксазола в отношении E.faecalis <0,5/9,5 мг/л и диаметре зоны подавления роста вокруг диска с этим АБП >20 мм.
5.3. Интегральный контроль качества определения чувствительности.
Наиболее доступным интегральным методом оценки качества определения чувствительности является сопоставление результатов определения чувствительности (МПК или диаметров зон подавления роста) контрольных (референтных) штаммов микроорганизмов с соответствующими показателями, приведенными в их паспортной характеристике. Тестирование контрольных штаммов проводят в соответствии с описанными выше методами, параллельно тестированию клинических изолятов.
Контрольные (референтные) штаммы микроорганизмов.
В качестве контрольных используют штаммы, отличающиеся генетической стабильностью и хорошо изученными фенотипическими характеристиками, в том числе и уровнем чувствительности к АБП. Если при исследовании чувствительности к АБП контрольных штаммов получены значения МПК или диаметров зон подавления роста, соответствующие паспортным характеристикам этих штаммов, то это свидетельствует о стандартности условий постановки эксперимента. Результаты определения чувствительности клинических изолятов, полученные в этих условиях, следует признать достоверными.
Выбор референтных штаммов для проведения контроля качества тестирования определяется видом исследуемого микроорганизма.
При детекции отдельных механизмов резистентности (бета-лактамазы расширенного спектра - БЛРС, метициллинрезистентности и др.) возникает необходимость использования контрольных штаммов, обладающих указанными механизмами.
Допустимые диапазоны значений МПК и диаметров зон подавления роста для основных контрольных штаммов представлены в таблицах 20–23.
5.4. Хранение контрольных штаммов.
В условиях лаборатории штаммы должны храниться таким образом, чтобы возможность мутаций и контаминации культуры была минимальной. Для этого создается банк контрольных штаммов, предназначенный для длительного хранения, а для ежедневной рутинной работы используются регулярно субкультивируемые культуры.
Для длительного хранения штаммов существуют два основных способа. Первый состоит в приготовлении суспензии микроорганизмов в стабилизирующем растворе (50% фетальной телячьей сыворотки в бульоне, 10-15% глицерина в триптиказо-соевом бульоне, дефибринированная баранья или кроличья кровь). Наилучшую сохранность культур удается получить при хранении в замороженном состоянии при температуре -70оС и ниже в морозильной камере или в жидком азоте. Другой метод длительного хранения контрольных штаммов - в лиофилизированном виде.
Для непродолжительного хранения “рабочих” контрольных штаммов их выращивают в пробирке со скошенным агаром (триптиказо-соевым или другим аналогичным для “непривередливых” микроорганизмов, шоколадным для “привередливых” бактерий) и хранят в холодильнике при температуре 2-8оС, субкультивируя еженедельно.
В случае, если “рабочие” контрольные штаммы были контаминированы или результаты определения чувствительности контрольного штамма не попадают в необходимые пределы, и это не может быть объяснено нарушениями методики определения чувствительности, “рабочий” штамм должен быть заменен на свежий из банка контрольных штаммов.
Перед использованием для контроля качества определения чувствительности хранившийся контрольный штамм должен быть дважды субкультивирован на подходящих питательных средах.
5.5. Частота проведения контроля качества.
Оптимальным является проведение контроля качества определения чувствительности с использованием набора контрольных штаммов ежедневно, параллельно с тестированием клинических изолятов.
Однако на практике, при получении достаточно стабильных результатов контроля качества в течение хотя бы одного месяца частота контрольных исследований может быть сокращена до 1 - 2 раз в неделю. Контрольные исследования необходимо проводить при использовании новых партий реагентов, прежде всего, питательных сред.
В то же время, если при проведении подобного тестирования получаемые результаты окажутся за пределами указанных границ, необходимо вернуться к ежедневному контролю качества для выяснения причины получения неправильных результатов.