В кишечнике человека находится свыше 500 видов микробов, общее количество которых достигает 1014, что на порядок выше общей численности клеточного состава человеческого организма.
Имеющиеся сведения о микробной флоре кишечника дают основание предполагать, что мы имеем дело с системой, сопоставимой по значимости с другими системами организма. Подтверждением являются следующие сведения лишь о некоторых важнейших физиологических функциях кишечной микрофлоры.
- Морфокинетическая (трофическая): продукты метаболизма микробов служат источником питания эпителиоцитов и стимулируют моторику кишечника.
- Защитная: обеспечение колонизационной резистентности, формирование биопленки, предотвращающей адгезию чужеродных микробов, продукция лизоцима, органических и свободных желчных кислот, конкуренция за рецепторы и пищевые субстраты, увеличение скорости обновления клеток и др.
- Пищеварительная: участие в метаболизме клетчатки и неусвоенных нутриентов.
- Синтетическая: синтез холестерина, витаминов и других биологически активных веществ.
- Иммуногенная: стимуляция синтеза иммуноглобулинов и иммунокомпетентных клеток.
- Участие в патогенезе целого ряда патологических состояний и заболеваний (канцерогенез, ожирение, гиперхолестеринемия, артериальная гипертензия, аллергия, артриты, оксалатурия и мочекаменная болезнь, болезнь Альцгеймера и др. [1].
К сожалению, уникальные свойства микробов, населяющих кишечник человека, не всегда учитываются при назначении антибиотиков. Антибактериальные препараты подавляют рост не только патогенных микроорганизмов, но и нормальную микрофлору кишечника.
В результате размножаются сапрофитные микробы с высокой устойчивостью к лекарственным препаратам, приобретающие патогенные свойства. К ним относятся стафилококки, протей, дрожжевые грибы, энтерококки, синегнойная палочка, клебсиелла.
Одним из частых осложнений лечения антибиотиками является острая диарея. По данным различных авторов, диареей страдают от 2 до 26% пациентов, получавших антибиотикотерапию [2].
Антибиотикоассоциированную диарею (ААД) особенно часто вызывают клиндомицин, линкомицин, ампициллин, пенициллин, цефалоспорины, тетрациклин, эритромицин. При этом способ назначения антибиотика особой роли не играет.
Так, при приеме внутрь помимо влияния на микроорганизмы происходит местное воздействие антибиотика непосредственно на слизистую оболочку тонкой кишки. При парентеральном введении антибиотики воздействуют на микробиоценоз кишечника, выделяясь со слюной, желчью, секретами тонкой и толстой кишок.
Симптомы ААД у большинства больных обычно появляются во время лечения, а у 30% – спустя 1–10 дней после его прекращения.
Непосредственным этиологическим фактором ААД большинство исследователей считают клостридии, в частности Clostridium difficile. Среди взрослого населения уровень ее носительства низкий и достигает 2–3%. Условиями размножения Clostridium difficileявляются анаэробная среда и угнетение роста нормальной флоры кишечника.
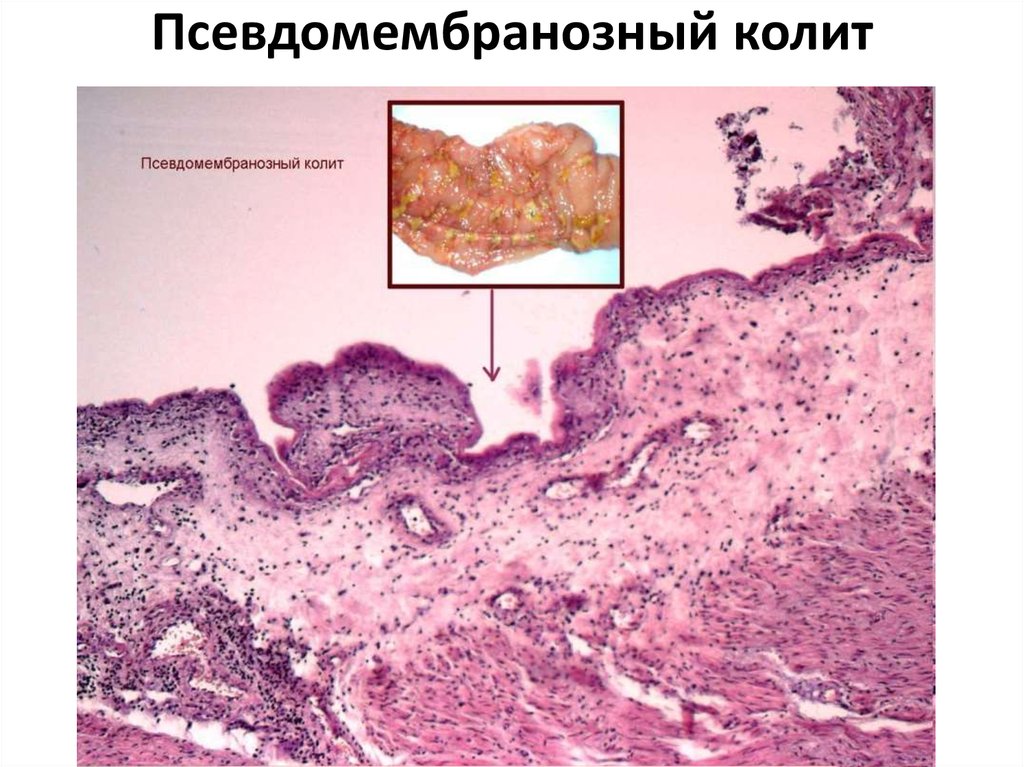
Клинические проявления ААД варьируют от легкой диареи до тяжелого псевдомембранозного колита (ПМК) [3]. ПМК — острое заболевание кишечника, развивающееся как осложнение антибактериальной терапии. Установлено, что его вызывает Clostridium difficile.
Клиника
Основным симптомом ААД и ПМК является обильная водянистая диарея, началу которой предшествовало назначение антибиотиков в течение нескольких дней и до месяца. Затем появляются схваткообразные боли в животе, стихающие после стула.
В тех случаях, когда повышается температура тела, в крови нарастает лейкоцитоз, а в кале также появляются лейкоциты, речь чаще всего идет о ПМК. После отмены антибиотика у некоторых больных симптоматика быстро исчезает.
При ПМК, несмотря на прекращение антибактериальной терапии, в большинстве случаев частота стула продолжает нарастать, появляется гипогидратация и гипопротеинемия. В особо тяжелых случаях начало заболевания может быть внезапным.
Быстро наступает обезвоживание. Развиваются токсическое расширение и перфорация толстой кишки. Очень редко может наблюдаться молниеносное течение ПМК, напоминающее холеру. Обезвоживание развивается в течение нескольких часов и заканчивается летальным исходом.
Диагноз
Диагноз ААД устанавливают на основании связи диареи с применением антибиотиков. Диагноз ПМК подтверждается бактериологическим исследованием кала и определением в нем токсина Clostridium difficile. Частота обнаружения токсина в кале больных с ААД не превышает 15% [4].
В то же время замечено, что у больных с диареей, ассоциированной с Clostridium difficile, наблюдается довольно значительный лейкоцитоз. Имеются данные, что у больных с лейкоцитозом 15,800/мм3 и выше имеется высокая вероятность развития ПМК, вызванного Clostridium difficile [5].
Это объясняется тем, что токсин А, выделяемый Clostridium difficile, вызывает воспаление, секрецию жидкости, лихорадку и судороги [6]. Поэтому у всех больных с ААД, протекающей с интоксикацией и лейкоцитозом 15,800/мм3 и выше, следует связывать причину острой диареи с Clostridium difficile.
Для диагностики дисбиоза кишечника все большее применение находят химические методы идентификации микроорганизмов, в частности газовая хроматография в сочетании с масс-спектрометрией (ГХ-МС), основанная на анализе больших баз данных, содержащих сведения о составе жирных кислот нескольких тысяч штаммов бактерий и микроскопических грибов [7].
Этот метод позволяет получить уникальную информацию о составе мономерных химических компонентов микробной клетки и метаболитов, которые могут быть определены и использованы для детектирования микроорганизмов [8].
Особенности состава жирных кислот теперь используются наряду с другими параметрами в бактериальной таксономии [9] и клинической бактериальной диагностике [10]. Возможности детектирования микроорганизмов методом ГХ-МС по их маркерным веществам, в том числе жирным кислотам, находят все более широкое применение в клинической медицине [11].
Мы применили метод ГХ-МС для оценки состава мукозной микробной флоры тонкой кишки у 30 больных ААД и установили следующее. Согласно нашим еще не опубликованным ранее данным ААД может быть связана не только с определенным инфекционным агентом (в частности, с Clostridium difficile), а с существенным изменением нормальной микрофлоры кишечника в основном в сторону увеличения концентрации у разных больных от 7 до 30 из 50 контролируемых микроорганизмов.
Общая колонизация слизистой оболочки тонкой кишки увеличивается в 2–5 раз по сравнению с нормой.
При изучении слизистой оболочки толстой кишки у больных с ААД чаще всего морфологические изменения отсутствуют. В более тяжелых случаях при эндоскопическом исследовании выявляют три типа изменений: 1) катаральное воспаление (отек и гиперемия) слизистой оболочки; 2) эрозивно-геморрагическое поражение; 3) псевдомембранозное поражение.
Эндоскопическая картина ПМК характеризуется наличием бляшковидных, лентовидных и сплошных "мембран", мягких, но плотно спаянных со слизистой оболочкой. Изменения наиболее выражены в дистальных отделах ободочной и прямой кишок.
Слизистая оболочка отечна, но не изъязвлена. При гистологическом исследовании обнаруживают субэпителиальный отек с круглоклеточной инфильтрацией собственной пластинки, капиллярные стазы с выходом эритроцитов за пределы сосудов.
На стадии образования псевдомембран под поверхностным эпителием слизистой оболочки образуются экссудативные инфильтраты. Эпителиальный слой приподнимается и местами отсутствует, оголенные места слизистой оболочки прикрыты лишь слущенным эпителием. В поздних стадиях болезни эти участки могут занимать большие сегменты кишки.
Дифференциальный диагноз
Связь диареи с антибактериальной терапией обычно не создает трудностей в диагностике ААД. Но в тяжелых (фатальных) случаях клиническая картина ПМК может очень напоминать холеру или фульминантную форму язвенного колита или болезни Крона. Однако для последних характерна более или менее выраженная кровавая диарея, не характерная для ПМК.
Тем не менее возможность развития эрозивно-геморрагических изменений слизистой оболочки при ААД не исключает появления кровянистых выделений из прямой кишки у некоторых больных, что может создавать дополнительные дифференциально-диагностические трудности.
Лечение
Этиотропной терапией ААД и ПМК, вызванных Clostridium difficile, считается назначение ванкомицина и метронидазола. Прежде всего отменяют антибиотик, обусловивший заболевание. Назначают ванкомицин по 125 мг внутрь 4 раза в сутки, при необходимости доза может быть увеличена до 500 мг 4 раза в сутки. Лечение продолжают в течение 7—10 сут. Эффективен также метронидазол в дозе 500 мг внутрь 2 раза в сутки.
Применяют, кроме того, бацитрацин по 25 000 ME внутрь 4 раза в сутки. Лечение проводят в течение 7—10 сут. Бацитрацин почти не всасывается, в связи с чем в толстой кишке можно создать более высокую концентрацию препарата. При обезвоживании применяют адекватную инфузионную терапию для коррекции водно-электролитного баланса. Для связывания токсина применяют холестирамин.
Недавно появились сообщения о возможности лечения острой диареи, ассоциированой с антибактериальной терапией, большими дозами пробиотиков. Так, S.Perskyp и L.Brandt (2000) установили, что нормальная человеческая бактериальная флора способна устранять поносы, ассоциированные с Clostridium difficile[12].
Эффект от такого лечения наблюдали также и другие авторы [13, 14]. Клиническое улучшение обычно наступало через несколько дней после начала бактериальной терапии. Бактерицидная природа фекальной флоры обеспечивает выздоровление более 95% больных с диареей, ассоциированной с Clostridium difficile.
Она предупреждает появление хронической клостридиальной или другой инфекции, которая может вызвать у части больных хронические желудочно-кишечные нарушения (например, запор, воспалительные и функциональные заболевания кишечника). Так, показано, что запор может быть устранен ванкомицином [15] и назначением бактериальных препаратов [16].
Бактериальную терапию при ААД, ПМК и острых кишечных инфекциях следует начинать как можно раньше, не дожидаясь бактериологического подтверждения точного диагноза [17].
В связи с тем что количество микробов, обеспечивающих лечебный эффект, на несколько порядков превышает дозы обычных бактериальных препаратов, обсуждается вопрос, каким образом бактериальные препараты должны доставляться в толстую кишку. Это можно делать с помощью клизм на основе солевых растворов [18, 19], через назодуоденальный зонд [18] или через колоноскоп [12].
Последний способ особенно привлекает внимание, так как представляется возможным не только установить диагноз, но и вводить пробиотики непосредственно в проксимальный отдел ободочной кишки. Может быть в будущем будет разработан отбор специальных доноров. В этом случае во избежание заражения больного донор должен быть протестирован на ВИЧ-инфекцию, маркеры вирусов гепатита, цитомегаловирусную и другие инфекции [17].
Возможно, для бактериальной терапии будут использовать комбинированные бактериальные смеси, имеющие сходство с человеческой фекальной флорой [20]. Авторы считают, что подобные смеси окажутся полезными не только для лечения клостридиальной инфекции, но и для лечения воспалительных болезней кишечника, этиология которых в настоящее время неизвестна.
Мы располагаем собственным опытом лечения 30 больных ААД бактериальным препаратом "Бифиформ". В отличие от стандартных доз (1 капсула 2 раза в день) мы применили более высокие дозы пробиотика.
Механизм действия бифиформа обусловлен быстрой колонизацией кишечника высокой концентрацией лиофилизированных бактерий (Bifidobacterium longum 107 и Enterococcus faecium 107), доставляемых в кишку энтеросолюбильной капсулой, защищающей микрофлору от агрессивного воздействия желудочного сока.
Бифиформ назначали при частоте стула 3–4 раз в день по 2 капсулы 3 раза в день При более частом стуле начальная доза составляла 8 капсул в день в течение 2–3 дней с постепенным снижением дозы до 1 капсулы 2 раза в день. Курс лечения составил 3 нед.
Положительная динамика в состоянии больных начала появляться с первых дней приема бифиформа. Начиная со 2–3-го дня уменьшалась частота стула, в течение первой недели лечения прекращались вздутие и урчание в животе. Болевой синдром держался более продолжительно, в связи с чем дополнительно назначали но-шпу, беллатаминал или белласпон.
Все больные хорошо переносили бифиформ. Побочных и аллергических реакций не отмечено.
До лечения у больных ААД при традиционном бактериологическом исследовании кала выявлялся дисбактериоз толстой кишки, отмечалось снижение представителей нормальной флоры толстой кишки (бифидо- и лактобактерий, бактероидов), увеличение условно-патогенных микроорганизмов и микроорганизмов со сниженными ферментативными свойствами.
Патогенные микроорганизмы не высевались. После 3-недельного курса лечения бифиформом в кале увеличивалось содержание бифидо- и лактобактерий, клостридии не выявлялись, условно-патогенные микроорганизмы определялись в допустимых количествах.
Следует отметить, что если положительная динамика в клиническом течении заболевания начинала появляться со 2–3-го дня лечения бифиформом, то дисбиотические изменения кишечника восстанавливались более медленно.
Профилактика
С целью профилактики ААД и ПМК назначение антибиотиков следует осуществлять только по строгим показаниям, своевременно прекращать антибактериальную терапию по достижении клинического эффекта и немедленно отменять препарат при появлении диареи и других симптомов ПМК.
Литература
1. Шендеров Б.А. Медицинская микробная экология и функциональное питание. Т. 1: Микрофлора человека и животных и ее функции. М.: ГРАНТЪ, 1998.
2. Gilbert DN. Infect Dis Clin Pract 1995; 4 (Suppl. 2): 103–9.
3. Григорьева Г.А. Тер. арх. 2001; 8: 75–8.
4. Gilligan PH, McCarthy LR, Genta VM. J Clin Microbiol 1981; 14: 26–34.
5. Bulusu M, Narayan S, Shetler K, Triadafilopoulos G. Am J Gastroenterol 2000; 95: 3137–41.
6. Flegel WA, Miller F, Daubener W et al. Infect Immun 1991; 59: 3659–64.
7. Axelsson В-О, Saraf A, Larsson L. J Chromatogr B 1995; 666: 77–84.
8. Chemical Methods in Bacterial Systematics (1985) (Goodfellow M and Minnikin DE, Eds.), Acad Press, London – Toronto.
9. Определитель бактерий Берджи. Под ред. Дж.Хоулта и др. М.: Мир, 1997; т. 1, 2.
10. Осипов Г.А., Демина A.M. Вестн. РАМН 1996; 13 (2): 52–9.
11. Осипов Г.А., Парфенов А.И., Богомолов П.О. Рос. гастроэнтерол. журн. 2001; 1: 54–69.
12. Persky SE, Brandt LJ. Am J Gastroenterol 2000; 95: 3283–5.
13. Gustafsson A, Lund-Tonnesn S, Berstad A et al. Scand J Gastroenterol 1998; 33: 721–7.
14. Lund-Tonnesen S, Berstad A, Schreiner A et al.Tidsskr Nor Laegeforen 1998; 118: 1027–30.
15. Celik AF, Tomlin J, Read NW. Aliment Pharmacol Ther 1995; 9: 63–8.
16. Andrews PJ, Borody TJ. Med J Aust 1993; 159: 633–4.
17. Borody TJ. Am J Gastroenterol 2000; 95 (11): 3028–9.
18. Flotterod O, Hopen G. Tidsskr Nor Laegeforen 1991; 111: 1364–5.
19. Paterson DL, Irdell J, Whitby M. Med J Aust 1994; 160: 232–3.
20. Pearce L, Bampton PA, Borody TJ et al. Gut 1997; 41 (suppl. 3): A63.