Одним из наиболее распространенных, длительно существующих и трудно корригируемых патологических состояний у детей, возникающих под влиянием разнообразных неблагоприятных факторов, является дисбактериоз кишечника.
Толстая кишка в этой ситуации является важным органом не только потому, что ей присущи специфические физиологические функции, но и в связи с тем, что она представляет собой биотоп с самой высокой степенью микробной обсемененности (более пятисот видов микроорганизмов).
Концепция современного состояния проблемы дисбактериозов кишечника основывается на представлении о микроэкологическом феномене, обусловленном изменением качественного и количественного состава микробной популяции кишечника.
Успехи детской гастроэнтерологии в диагностике и лечении определяются в первую очередь расшифровкой этиологических факторов и внедрением в клиническую практику основных методов распознавания факультативных и облигатных бактерий.
Чрезвычайно доказательными являются данные сегодняшнего дня, согласно которым экопатогенные факторы (к ним относятся лекарственные препараты, состав пищевого рациона, функциональные нарушения органов и систем, болезни, многочисленные стрессы и др.) реально способны инициировать ряд механизмов, обеспечивающих экспрессию генетически детерминированных атипичных свойств микроорганизмов, повышать уровень мутаций, приводить к созданию нового микроэкологического равновесия, не всегда отвечающего понятию симбиоза.
Утверждается точка зрения, согласно которой при возникающем микроэкологическом дисбалансе происходит формирование штаммов персистирующих потенциально-патогенных бактерий, способных при ослаблении защитных сил организма ребенка утяжелять течение хронического заболевания. С другой стороны, особого внимания заслуживает установленный факт формирования дефицита целого ряда микроорганизмов, прежде всего бифидобактерий и лактобацилл.
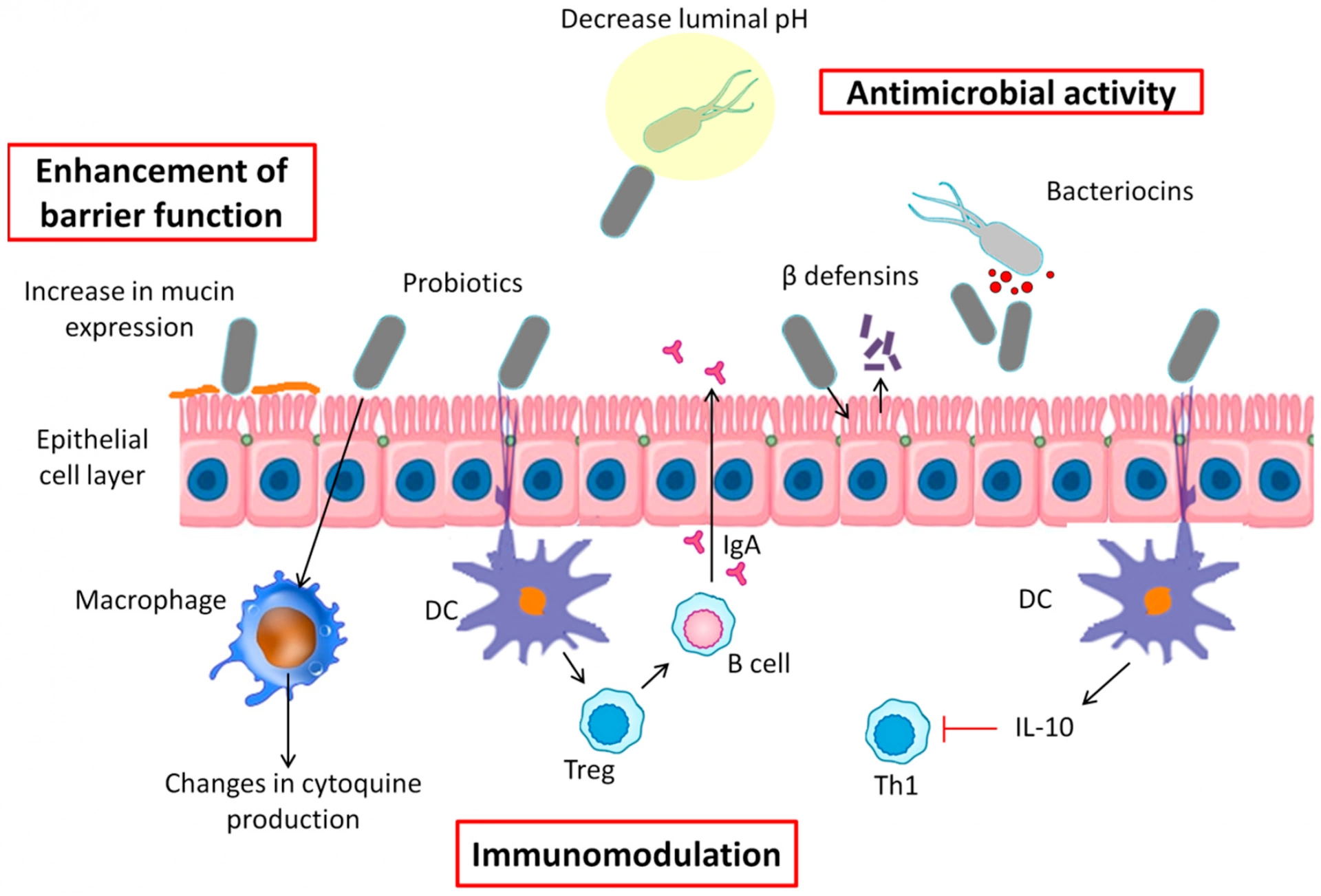
В этих условиях вероятно значительное снижение естественных защитных систем организма, осуществляемых с помощью следующих механизмов: микрофлора и барьерный эффект, эпителий/слизь и иммунитет.
С этих позиций чрезвычайно остро встает вопрос равноценности медикаментозной коррекции. Успех ее во многом определяется комплексным подходом с учетом индивидуальных особенностей организма ребенка и, что чрезвычайно важно, клиники, стадии и характера течения основного заболевания.
Эффективная коррекция дисбактериозов немыслима без рационального использования пробиотиков (Probiotic – микроорганизм, участвующий в симбиозе с макроорганизмом), правильного их выбора и адекватности схем применения.
Наш интерес и наши знания в проблеме применения пробиотиков в клинической практике значительно расширились. Накопленные наблюдения показывают, что разные штаммы пробиотиков, входящие в состав биотерапевтических препаратов, могут изменять не только состав, но и функцию микрофлоры толстой кишки.
Вполне доказано регулирующее влияние штаммов бифидо- и лактофлоры на водно-солевой обмен, метаболизм углеводов, белков, липидов, нуклеиновых кислот, стероидов и других физиологически активных соединений.
Пробиотики обладают морфокинетическим действием, участвуют в регуляции желчных кислот, обеспечивают колонизационную резистентность и предотвращают транслокацию патогенов, стимулируют синтез эндогенного интерферона, принимают участие в иммуногенезе (регулируют продукцию цитокинов, функциональную активность фагоцитирующих клеток, NK-лимфоцитов, стимулируют синтез иммуноглобулинов) и репаративных процессах в различных биотопах организма.
Таким образом, бактериальные клетки пробиотика можно рассматривать как биокатализаторы многих жизненно важных процессов в организме человека.
В настоящее время клиницисты располагают огромным арсеналом современных фармакологических препаратов, содержащих как представителей только одного вида бактерий (монопробиотики), так и ассоциацию штаммов нескольких видов микроорганизмов (ассоциированные или поликомпонентные пробиотики).
Широкое применение имеют и комбинированные пробиотики, например бифидумбактерин форте, бифилиз. В практику внедрены биопрепараты в таблетках, ректальных и вагинальных свечах, перспективны мази, кремы, инъекционные формы пробиотиков. Создаются биологические формы препаратов в комплексировании с интерфероном, иммуноглобулинами, витаминами.
Дальнейшие исследования направлены на создание биопрепаратов нового поколения на основе микробных метаболитов и продуктов дезинтеграции микробных клеток, содержащих генно-инженерные штаммы.
К бактерийным биологическим препаратам отработаны определенные требования, которые сводятся к следующему: микроорганизмы должны проявлять положительный эффект на организм хозяина; при длительном использовании – не оказывать побочных эффектов; должны сохраняться в пищеварительном тракте до достижения максимального положительного эффекта.
Учитывая, что бифидобактерии составляют основную часть микробиоты кишечника, основным способом коррекции их дефицита является терапия различными препаратами, содержащими бифидобактерии.
Исследование биологических свойств бактерий рода Bifidobacterium показало, что всем им свойствен полиморфизм, они строгие анаэробы, являются сахаролитическими микробами, продуцируют широкий спектр органических кислот и многоатомных спиртов.
Сложный состав продуктов метаболизма кислотообразующих бактерий в кишечнике служит фактором регуляции биоценоза и морфофункционального состояния слизистой оболочки, и, опосредованно, моторно-эвакуаторных функций желудочно-кишечного тракта. В ряде исследований получены доказательства антианемического, антирахитического, антиаллергического и антихолестеринемического действия бифидобактерий.
Среди современных бифидосодержащих пробиотиков особого внимания заслуживают препараты нового поколения, обладающие выраженной комплексной биологической активностью и высокой степенью безопасности: бифилиз и бифиформ.
Бифилиз содержит лиофилизированную микробную массу B. bifidum штамм №1 и лизоцим. Одна доза – не менее 100 млн живых бифидобактерий и 10 мг лизоцима. Оптимальное сочетание бифидобактерий и лизоцима усиливает лечебное действие каждого компонента в препарате.
Лизоцим обладает бифидогенным, иммуномодулирующим, противовоспалительным действием, стимулирует метаболические и репаративные процессы, улучшает пищеварение, проявляет синергизм со многими антибиотиками.
По обобщенным данным отечественных исследователей [1–4] отмечена достоверная эффективность бифилиза в коррекции дисбиотических изменений кишечника у взрослых и детей всех возрастных групп, в том числе у ослабленных новорожденных и грудных детей при искусственном и смешанном вскармливании, у больных с аллергическими заболеваниями, вторичными иммунодефицитными состояниями, при тяжелых инфекционно-воспалительных заболеваниях.
Важно, что бифилиз может применяться на фоне антибиотиков и цитостатиков, снижая их побочное (дисбиотическое и токсическое) воздействие на организм. Он хорошо сочетается с препаратами и продуктами, содержащими лактобациллы.
Подробный анализ клинических испытаний эффективности бифилиза и бифидумбактерина свидетельствует о значительных преимуществах первого пробиотика. Установлено, что под его влиянием происходит более быстрая и стойкая коррекция микробиоценоза и морфофункционального состояния кишечника, ряда показателей гомеостаза и иммунологической реактивности организма.
Детальное изучение состава микрофлоры толстой кишки у часто болеющих детей с включением бифилиза в комплексную реабилитацию больных позволило снизить заболеваемость острыми респираторно-вирусными инфекциями в 1,5 раза, уменьшить аллергические проявления, нормализовать стул, значительно улучшить показатели микробиоценоза кишечника [3].
Бифиформ содержит не менее 107 Bifidobacterium lobgum, а также 107 Enterococcus faecium. Капсула препарата покрыта энтеросолюбильной оболочкой, благодаря чему бактерии "защищены" от повреждающего воздействия желудочного сока; в состав капсулярной оболочки входит особая питательная среда, необходимая для роста и размножения молочнокислых бактерий.
Изучено влияние бифиформа на микробиоценоз кишечника у больных с гастродуоденальной патологией, с синдромом нарушенного кишечного всасывания наследственного или приобретенного генеза (муковисцидоз, целиакия, хронический энтерит, дерматоинтестинальная форма аллергии), острыми кишечными инфекциями [5–9].
Анализ динамики клинических симптомов показал, что препарат оказался эффективным как в комплексной, так и в монотерапии при купировании основных клинических проявлений болезни. В то же время необходимо отметить отчетливый корригирующий эффект на качественный и количественный состав энтерофлоры организма.
Установлено, что бифиформ повышает сопротивляемость пищеварительной системы за счет иммуномодулирующего эффекта и активации антиэндотоксиновых звеньев защиты. Положительное влияние увеличенных доз препарата на процессы купирования диареи, исчезновение болевого синдрома, метеоризма уже с первых дней применения и отсутствие побочных эффектов позволяют рекомендовать бифиформ к использованию с целью профилактики и лечения антибиотикоассоциированной диареи [10].
Проведенные клинические испытания бифиформа с целью коррекции дисбактериозов кишечника у лиц с атопическими заболеваниями подтвердили его клиническую эффективность. Достигнута быстрая нормализация стула, положительная весовая кривая, купирование метеоризма. Отмечена стимуляция гуморального звена иммунитета в виде увеличения числа иммуноглобулина G и особенно иммуноглобулина М [9].
Препарат производится из натуральных продуктов, удобен в применении и не оказывает побочных эффектов даже у детей с поливалентной (пищевой и лекарственной) аллергией [6].
Помимо указанных средств, доказана эффективность лактосодержащих пробиотиков, действующим началом которых являются живые лактобациллы. Подавление гнилостных микробов и антибактериальная активность лактобактерий связаны с выработкой молочной кислоты, спирта и лизоцима, продуктов с высокой антибиотической активностью, интерферонов, интерлейкина 1 и др.
Лактобациллы выделяют различные ферменты и витамины, принимающие участие в пищеварительной деятельности желудочно-кишечного тракта и обменных процессах. Исчезновение лактобактерий приводит к сдвигу рН толстой кишки в щелочную сторону, резко снижая утилизацию слизистой оболочкой биологически активных соединений.
Доказано, что длительный прием живых ацидофильных лактобацилл приводит к существенному повышению в сыворотке крови уровня общего кальция, его ионизированной формы и фосфора.
Корригирующую терапию лактосодержащими пробиотиками можно назначать совместно или последовательно в течение 2–3 сут после лечения специфическими бактериофагами, предназначенными для элиминации условно-патогенных бактерий, или с химиотерапевтическими препаратами направленного действия.
Среди лактосодержащих препаратов имеет четкое преимущество биомасса ацидофильных лактобактерий "Наринэ", которая представляет собой высушенную в вакууме культуру живых человеческих молочнокислых лактобактерий ацидофильной группы штамма 317/402.
Наринэ нормализует микрофлору кишечника. Имеет высокую антагонистическую активность в отношении широкого круга патогенных и условно-патогенных микроорганизмов (возбудителей дизентерии, сальмонеллеза, патогенной кишечной палочки, стрептококков, стафилококков, протея и др.), улучшает усвоение железа, кальция и других микроэлементов, нормализует уровень гемоглобина и обменные процессы, повышает устойчивость к инфекционным, токсическим и другим неблагоприятным факторам.
Данные исследования М.Н.Якушенко и соавт. [11] показали, что у детей с атопическим дерматитом назначение наринэ в возрастной дозировке в течение 20 дней с переходом на замену одного кормления кисломолочной смесью наринэ длительностью от 6 мес до 1 года приводило к исчезновению всех клинических проявлений (восстановление нормального состояния кожи, повышение аппетита, улучшение эмоционального состояния, исчезновение абдоминального синдрома, срыгиваний у детей до года), к нормализации анаэробной флоры кишечника.
Особый интерес представляют результаты влияния наринэ на побочные эффекты при антихеликобактерной терапии. Доказано, что назначение лактобактерий в период и после недельного курса антихеликобактерной терапии у больных с язвенной болезнью двенадцатиперстной кишки значительно уменьшает побочные действия и улучшает переносимость лечения [12].
В сравнительном плацебо-контролируемом исследовании [13], в котором участвовали больные раннего возраста с кишечными инфекциями установленной этиологии, протекавшими в затяжной форме, эффективность наринэ составила 85,7%. Полная нормализация стула у 61,9% больных достигнута к 5–6-му дню, у 23,8% – к 7–8-му дню лечения.
В группе сравнения клиническая эффективность определена в 68,8% с нормализацией стула к 5-му дню лечения лишь у 3,5% больных. Состояние микроэкологии кишечника характеризовалось снижением в процессе лечения наринэ частоты выявления гемолизирующих форм кишечной палочки (в 2,5 раза), условно-патогенных энтеробактерий (в 2 раза).
Многочисленные клинические исследования доказали эффективность и хорошую переносимость пробиотиков, содержащих культуры бактерий, обладающих антагонистической активностью. Однако эта фармакологическая группа неоднородна. На сегодняшний день оптимальным препаратом из этой группы представляется энтерол, который в своем составе имеет живые биотерапевтические агенты – дрожжи Saccharomyces boulardii.
Биологические свойства обусловлены выраженными антагонистическими эффектами лечебных дрожжей по отношению к широкому спектру патогенных и условно-патогенных микроорганизмов (Clostridium difficili, Escherichia coli, Salmonella typhi, Shigella dysenteriae, Candida albicans, Candida pseudotropicalis, Candida krusei, Klebsiella spp., Proteus spp., Pseudomonas aeruginosa, Staphylococcus aureus и др.), угнетением способности бактерий к образованию токсинов и их нейтрализацией, усилением неспецифической противоинфекционной защиты и активности дисахаридаз (лактазы, мальтазы и др.).
Кроме того, энтерол высвобождает полиамины (спермин, спермидин), оказывающие местное трофическое действие на слизистую оболочку кишки. Повышение иммунологической защиты обусловлено стимуляцией лечебных дрожжей секреторного Ig А.
Хорошая переносимость энтерола подтверждена в многочисленных клинических исследованиях. Так, применение данного пробиотика убедительно доказало его широкий спектр антагонистической активности к условно-патогенным микроорганизмам, а также иммунокорригирующие свойства и трофический эффект у детей с хроническим гастродуоденитом и выявленными дисбиотическими нарушениями в толстой кишке [14].
Было показано, что включение энтерола в комплексную терапию детей первого года жизни с атопическим дерматитом позволяет не только нормализовать микроэкологию толстой кишки, но и получить хорошие клинические результаты. Достигнуты быстрая нормализация стула, положительная весовая кривая, купирование метеоризма.
Отмечена стимуляция клеточного звена иммунитета в виде увеличения числа CD3-, CD4-, CB8-лимфоцитов и NK-клеток [9]. Указывается на подобный эффект и в отношении лечения диареи у онкологических больных, получавших химио- и лучевую терапию [15].
Энтерол из расчета 1/2 пакета 2–3 раза в сутки рекомендуется использовать в качестве селективной стимуляции индигенной микрофлоры при дисбактериозе кишечника у недоношенных новорожденных [16].
Анализ проведенных наблюдений за детьми с дисбактериозом кишечника различной степени, получавших энтерол, показал раннюю ликвидацию диспепсического и болевого синдрома, снижение метеоризма, нормализацию стула у 91% больных на 2–3-й день от начала лечения. Доказано достоверное подавление роста стафилококков, грибов рода Candida, с одновременным увеличением числа бифидо- и лактобактерий.
У 12,9% детей с пищевой аллергией было отмечено значительное уменьшение кожных аллергических проявлений заболевания, отмечалось усиление неспецифической иммунной защиты [17].
Обсуждая проблемы применения пробиотиков в коррекции и профилактике дисбактериозов у детей, нельзя не обратить внимание на хилак-форте, имеющий в составе оптимизированный набор продуктов метаболической активности – молочную кислоту, аминокислоты, короткоцепочечные жирные кислоты. Имеющиеся к настоящему времени данные позволяют считать хилак-форте весьма перспективным пробиотиком метаболитного типа.
Хорошо доказано, что хилак-форте реализует свое положительное влияние на физиологические функции макроорганизма в результате модуляции аутоиммунных реакций, изменения функций макрофагов, продукции цитокинов, активации иммунной системы, связанной со слизистыми оболочками.
Он создает оптимальный рН в просвете кишечника, является мягким регулятором моторной функции толстой кишки, ингибирует рост условно-патогенных микроорганизмов, повышая колонизационную резистентность слизистой оболочки толстой кишки, способствует быстрому восстановлению микроэкологического статуса через нормализацию индигенной микрофлоры: бифидо- и лактобактерий.
Компоненты хилак-форте помимо создания условий для роста нормальной микрофлоры являются источником питания кишечного эпителия, способствуют его регенерации и нормализации функций, участвуют в процессах адаптации рецепторного аппарата толстой кишки к его содержимому, что чрезвычайно важно при синдроме раздраженного кишечника.
В отечественной литературе имеются многочисленные сообщения о самом широком наборе дополнительных свойств, позволяющим хилак-форте быть эффективным пробиотиком в коррекции дисбиотических нарушений кишечника.
Исследования [10] показали высокую терапевтическую результативность хилак-форте при назначении больным с синдромом раздраженного кишечника. Было выявлено, что включение данного пробиотика в комплексную терапию способствует более раннему клиническому выздоровлению и восстановлению кишечного микробиоценоза, что сокращает сроки реабилитации и снижает затраты на восстановительную терапию.
Последний факт тем более важен, так как обеспечивает достижение консенсуса между высокой клинической эффективностью и минимизацией материальных издержек, связанных с приобретением препарата.
Изучено применение хилак-форте у детей с обстипационным вариантом синдрома раздраженного кишечника, ассоциированного c дисбактериозом [7, 14]. Показано, что у этих больных значительно меняется микрофлора фекалий, которая характеризуется резким смешанным дефицитом лакто- и бифидобактерий и увеличением пропорции аэробных энтеробактерий, бактероидов и анаэробных грамотрицательных бактерий, грамположительных аэробных и анаэробных кокков.
Включение хилак-форте в комплекс лечебных мероприятий приводило к более быстрому купированию клинической симптоматики. Отчетливый элиминационный эффект пробиотика получен в отношении клебсиелл, цитобактера и грибов рода Candida, что сопровождалось в свою очередь нормализацией количественного содержания бифидобактерий, лактобацилл, кишечной палочки и энтерококков.
При адекватной дозе и длительном применении не было выявлено никаких побочных действий препарата. Последние факты делают целесообразным рекомендацию использования хилак-форте в случаях изменения перистальтики и транзита по толстой кишке [18].
Доказана эффективность хилак-форте при дисбактериозе кишечника у недоношенных новорожденных [16]. Препарат рекомендуется использовать в качестве селективной стимуляции индигенной микрофлоры из расчета 5–10 капель на 1 кг массы тела 2–3 раза в сутки.
Н.И.Леонтьева и соавт. [19] изучали влияние хилак-форте на лечение больных с острой кишечной инфекцией и хроническими заболеваниями желудочно-кишечного тракта с явлениями дисбактериоза кишечника. Хилак-форте способствовал сокращению сроков клинических проявлений основного заболевания и более ранней элиминации условно-патогенных микроорганизмов, особенно грибов рода Candida.
Критерием эффективности хилак-форте было нормализующее действие его на летучие жирные кислоты, их изоформы, а также рН фекалий, количества нейтральных и солей жирных кислот. При этом отмечалось выраженное репаративное действие исследуемого пробиотика на слизистую оболочку толстой кишки: увеличивалась высота поверхностного эпителия с уменьшением в нем дистрофических изменений.
В ходе другого клинического исследования [20] авторы отметили, что хилак-форте не только снижает тяжесть и длительность инфекционной диареи, но и приводит к устранению атрофических процессов в слизистой оболочке толстой кишки, исчезновению дистрофических изменений эпителиального пласта и восстановлению его функциональной способности, снижению степени активности патологического процесса в ней, а также сопровождается санацией пристеночной микробиоты от кампилобактерий.
Выраженный лечебный эффект хилак-форте был продемонстрирован в исследовании, проведенным В.А.Петуховым и соавт. [21]. Изучая механизмы этиопатогенеза липидного дистресс-синдрома, авторы обнаружили выраженные нарушения функции печени, характерные для жирового гепатоза. Показатели метаболизма печени находились в прямой корреляционной зависимости с уровнями и профилями летучих жирных кислот в кале, а также величиной анаэробного индекса.
Терапию хилак-форте проводили в течение 2–6 мес в зависимости от тяжести нарушений. Препарат, восстанавливая структурно-метаболические нарушения микробиоценоза толстой кишки при липидном дистресс-синдроме, способствовал нормализации метаболических функций печени.
Эти же авторы [22] привели обнадеживающие клинические данные о возможности применения хилак-форте в профилактическом лечении пациентов с желчнокаменной болезнью. Сообщается, что причиной выраженных нарушений различных функций печени при данном заболевании является декомпенсированный дисбиоз толстой кишки, который проявляется снижением общего уровня летучих жирных кислот, повышением анаэробного индекса и снижением числа бифидо- и лактобактерий.
В этом исследовании было показано, что включение хилак-форте в программу подготовки больного к плановой холецистэктомии значительно снижало риск развития послеоперационных осложнений и приводило к восстановлению нормального микробиоценоза толстой кишки, активности ретикулоэндотелиальной системы печени, что сопровождалось в свою очередь улучшением метаболических процессов в ней.
Учитывая доказанную успешную фармакологическую роль хилак-форте в комплексном лечении острых и хронических неспецифических воспалительных заболеваний органов пищеварения у взрослых и детей всех возрастных групп, данный пробиотик заслуживает самого серьезного отношения и может быть рекомендован для применения в широкой медицинской практике.
Заключение
Анализ публикаций последних лет показывает, что на современном этапе проблема дисбактериозов у детей по-прежнему сохраняет общемедицинское значение. На наш взгляд, оптимальным выходом из создавшейся ситуации должно быть дифференцированное назначение современных пробиотиков, в отношении которых проводились сравнительные клинические и фармакокинетические исследования.
Старые, давно используемые пробиотики: бифидумбактерин, лактобактерин, колибактерин – существенно уступают по клиническому результату любому из представленных в обзоре препаратов. Относительная дешевизна перестает быть их преимуществом, если учесть низкую эффективность, высокую вероятность рецидива дисбиотических нарушений и развитие побочных эффектов.
Представляется уместным еще раз подчеркнуть, что вопросы назначения конкретного пробиотика должны решаться лечащим врачом в зависимости от клинической и микробиологической картины.
Литература
1. Грачева Н.М., Щербакова Э.Г. и др. Применение бифилиза у больных с ОКИ и при дисбактериозе кишечника. М., Новые лекарствен. преп. 1998; 9: 41–9.
2. Кузнецова М.А. Состояние толстой кишки у детей с аллергическими заболеваниями. Автореф. дис. ... канд. мед. наук. М., 2003.
3. Рубачева О.Е., Федько Н.А., Сербина О.П. Характер микробиоценоза толстого кишечника у часто болеющих детей. Материалы VIII конгресса педиатров России "Детская гастроэнтерология: настоящее и будущее". М., 2002; с. 246.
4. Щербакова Э.Г., Долинский А.Г., Агафонова С.Ю., Архипова Н.А. Эффективность применения Бифилиза в лечении микробиоценоза кишечника. Там же. С. 66.
5. Ардатская М.Д., Дубинин А.В., Минушкин О.Н. Дисбактериоз кишечника: современные аспекты изучения проблемы, принципы диагностики и лечения. Тер. арх. 2001; 2: 67–71.
6. Микробная флора кишечника и пробиотики (методическое пособие). Запруднов А.М., Мазанкова Л.Н. М., 2001.
7. Урсова Н.И., Римарчук Г.В., Савицкая К.И. К проблеме дисбиоза кишечника у детей. Детская гастроэнтерология и проблемы педиатрии. Вчера, сегодня, завтра. Н.-Новгород, 1999; с. 131–3.
8. Парфенов А.И. Постинфекционный синдром раздраженного кишечника: вопросы лечения и профилактики. Consilium medicum. 2001; 6: 298–300.
9. Фомин В.В., Калугина Т.В. Коррекция дисбактериоза кишечника у детей, перенесших заболевания желудочно-кишечного тракта. Материалы VIII конгресса педиатров России "Детская гастроэнтерология: настоящее и будущее". М., 2002; 313 с.
10. Парфенов А.И., Ручкина И.Н., Осипов Г.А. Антибиотикоассоциированная диарея и псевдомембранозный колит. Consilium medicum. 2002; 2: 24–7.
11. Якушенко М.Н., Тхагапсоева Ж.М., Бондаренко В.М. Регуляция микроэкологических нарушений кишечника у новорожденных детей с перинатальной патологией новым пробиотиком бифидумбактерин-форте. Журн. микробиол. 1997; 6: 18–21.
12. Хомерики Н.М., Хомерики С.Г. Влияние лактобактерий и антиоксидантов на побочные эффекты при антихеликобактерной терапии. Рос. журн. гастроэнтерол., гепатол., колопроктол. 2002; 5 (XII): 41.
13. Покатилова А.И., Феклисова Л.А., Комкова Н.Н и др. Использование лактосодержащего кисломолочного продукта при затяжных инфекциях у детей. Материалы научно-практической конференции педиатров России "Фармакотерапия инфекционных болезней у детей" М., 2001; 58 с.
14. Урсова Н.И. Роль и место пробиотиков в лечении и профилактике различных заболеваний и состояний, обусловленных дисбиотическими нарушениями кишечника. Научный обзор. М., 2002.
15. Петухова И.Н., Иванова Л.Ф., Дмитриева Н.В. Комбинация Энтерола и бифидум- и лактобактерина в лечении диареи после химио- и лучевой терапии. Новое в онкологии. "К 50-летию РОНЦ". 2001; с. 24–31.
16. Акоев Ю.С. Функциональные особенности недоношенных детей в раннем онтогенезе. Автореф. дис. ... д-ра мед. наук. М., 1999.
17. Савво В.М. Лечение дисбактериоза у детей с применением препарата Энтерол-250. Материалы VIII конгресса педиаI конгресса педиатров России "Детская гастроэнтерология: настоящее и будущее". М., 2002; с. 254.
18. Урсова Н.И., Римарчук Г.В. Опыт лечения функциональных запоров у детей. Материалы конференции педиатров России "Фармакотерапия и фармакогенетика в педиатрии". М., 2000; 168 с.
19. Леонтьева Н.И., Щербаков И.Т., ПартинО.С. и др. Применение Хилак-форте у больных острыми и хроническими заболеваниями желудочно-кишечного тракта и дисбактериозом кишечника. Материалы IX Российского национального конгресса "Человек и лекарство". М., 2001; с. 262.
20. Щербаков И.Т., Грачева Н.М., Аваков А.А. и др. Патоморфология слизистой оболочки толстой кишки у больных с острыми кишечными инфекциями до и после лечения бифидумбактерином-форте. Практикующий врач. 1999; 3 (16): 19–21.
21. Петухов В.А., Каралкин А.В., Думпе Л.Э., Туркин П.Ю. Нарушение функции печени при липидном дистресс-синдромие в хирургии и их коррекция препаратом Хилак-форте. Материалы X Российского национального конгресса "Человек и лекарство". М., 2002; с. 348.
22. Петухов В.А., Каралкин А.В., Думпе Л.Э., Туркин П.Ю. Нарушение функции печени при желчнокаменной болезни и их коррекция препаратом Хилак-форте. Материалы X Российского национального конгресса "Человек и лекарство". М., 2002; с. 348.