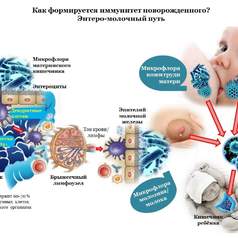
Традиционные подходы к этиопатогенезу многих широко распространенных заболеваний, основанные на исключительной роли клеток, тканей либо органов человека, больше не способны дать новых конструктивных идей, позволяющих разрабатывать высокоэффективные формы и методы профилактики и лечения.
Любое заболевание по сути является следствием нарушенного гомеостаза. В этой связи микрофлора является его важнейшим фактором и рассматривать патологию вне связи с микробиоценозом представляется абсурдным. Микроэкологические нарушения в организме человека следует считать пусковыми механизмами нарушений липидного обмена и патологических процессов, связанных с ними, таких как атеросклероз, желчнокаменная болезнь, функциональные расстройства органов пищеварения и др.
Точные механизмы участия представителей микрофлоры организма человека и продуктов их жизнедеятельности в этиопатогенезе этих заболеваний окончательно не установлены, но микроэкологические подходы к пониманию их развития могут явиться отправной точкой создания новых методов лечения.
Это становится очевидным при ясном понимании того, что микробиота пищеварительного тракта является первичной мишенью воздействия любых токсических соединений, к которым необходимо отнести отдельные компоненты пищи, все лекарства, в первую очередь антибиотики.
Рассмотрим наиболее типичные реакции микрофлоры на токсиканты любого происхождения. Их можно с некоторой долей условности разделить на:
- кратковременные, легко обратимые и не сопровождающиеся изменением биохимических реакций и физиологических функций организма, прекращающиеся тотчас после воздействия агента. Это стрессовые реакции микробиоты как внекорпорального органа организма человека;
- стойкие изменения микроэкологических показателей, сохраняющиеся и после окончания повреждающего воздействия. Традиционные микробиологические маркеры таких реакций включают снижение количества бифидум- и лактобактерий, повышение числа аэробных энтеробактерий. Сохраняющиеся впоследствии патологические биохимические реакции и нарушения физиологических функций, в первую очередь печени, свидетельствуют о прогрессировании микроэкологических нарушений.
Человеку свойствен только ему присущий микроэкологический гомеостаз, поэтому возможны и другие проявления микроэкологического кризиса.
Изменения микробиоценоза происходят не изолированно, при этом нарушается биопленка. Это до сих пор еще полуабстрактное понятие представляет собой мукополисахаридную “перчатку”, покрывающую всю кожу и все без исключения слизистые оболочки.
Она предотвращает проникновение в ее нижние слои экзогенных микроогранизмов, поступающих с водой, пищей и т.д., а для эндогенных микроорганизмов является препятствием для адгезии и колонизации участков, им не свойственных.
Биопленка слизистых оболочек человека состоит помимо экзополисахаридов микробного происхождения из микроколоний аутохтонной микрофлоры и муцина, секретируемого бокаловидными клетками.
Нарушения биопленки происходят: 1) на фоне гибели аутохтонных микроорганизмов, обеспечивающих колониальную резистентность; 2) при нарушении синтеза микробных полисахаридов, истончении биопленки и доступа потенциальных патогенов к рецепторам эпителиальных клеток в этих участках; 3) при истончении и замене старой биопленки новой, сформированной оппортунистическими патогенами экзо- и эндогенного происхождения.
Таким образом, биопленка является продуктом совместной деятельности организма и микрофлоры.
Обладая многочисленными факторами специфической и неспецифической защиты, она, кооперативно взаимодействуя со внутрипросветной и пристеночной микрофлорой и макроорганизмом, защищают экосистему от патогенной микрофлоры (колонизационная резистентность).
К признакам высокой колонизационной резистентности относят обнаруживаемый в фекалиях один (максимум два) биотоп энтеробактерий, средней – 2–3 биотопа, низкой – более 3 биотопов. Снижение колонизационной резистентности происходит при нарушении конкуренции за пищевые субстраты, продукции стимуляторов или ингибиторов роста микроорганизмов, изменении окислительно-восстановительного потенциала и др.
Нарушение колонизационной резистентности с учетом многочисленных метаболических функций микрофлоры можно считать одним из наиболее вероятных пусковых факторов различных заболеваний, в первую очередь печени.
В дальнейшем, при манифестировании патологии какого-либо органа, трудно выделить снижение колонизационной резистентности кишечника в самостоятельное патогенетическое звено, так как различные метаболические нарушения объединяются в единый дисметаболический процесс. Это доказано на примере липидного дистресс-синдрома Савельева.
Микрофлора желудочного-кишечного тракта (ЖКТ) и печень неразрывно взаимодействуют в процессах детоксикации организма. Микробиота в составе биопленки первой вступает в контакт и последующие метаболические реакции со всеми субстанциями, поступающими в организм с пищей, водой или воздухом атмосферы. Микробиота трансформирует химические вещества в нетоксические конечные продукты либо в промежуточные соединения, легко разрушаемые в печени и затем удаляемые из организма.
В организме существует два основных детоксицирующих органа – печень, осуществляющая защиту организма посредством окислительных реакций, и микрофлора пищеварительного тракта, использующая для этих целей гидролитические восстановительные процессы. Нарушение взаимодействия этих систем приводит к взаимным функциональным и структурным изменениям в них самих и организме в целом.
Поэтому энтерогепатическую циркуляцию различных органических и неорганических соединений можно без преувеличения причислить к кардинальным гомеостатическим механизмам. Снижение детоксикационной функции микрофлоры ЖКТ при дисбиозе, обусловленном различными патогенами (лекарства, пища, стресс и т.д.), увеличивает нагрузку на ферментативные системы печени и при определенных условиях способствует возникновению в ней метаболических и структурных изменений.
При дисбалансе микроэкологии пищеварительного тракта увеличение пропорции потенциально патогенных грамотрицательных бактерий ведет к значительному накоплению в просвете кишечника эндотоксинов. Последние, проникая через слизистую оболочку кишечника в местную систему кровообращения, а затем через воротную вену в печень, вызывают повреждения гепатоцитов или потенцируют неблагоприятные действия других токсикантов. 90% всех эндотоксинов высвобождается факультативно анаэробными грамотрицательными бактериями.
Эндотоксины повреждают клеточные мембраны, нарушают ионный транспорт, вызывают фрагментацию нуклеиновых кислот, индуцируют образование продуктов свободнорадикального окисления, инициируют апоптоз и т.д.
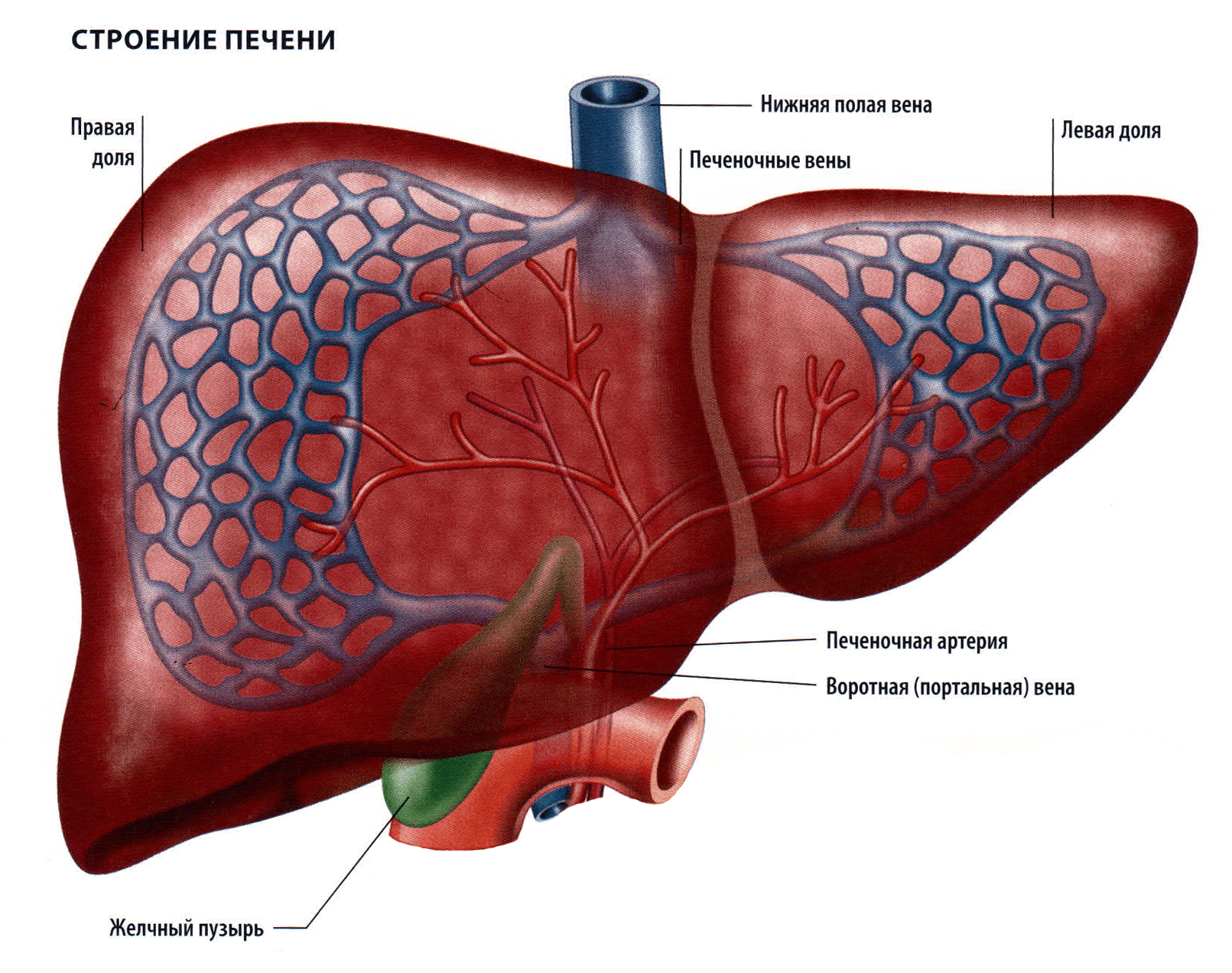
В клинической медицине анализ функций печени, как правило, подразумевает деятельность гепатоцитов или паренхиматозных клеток. Вместе с тем уже около века известны особые клетки, встроенные в стенки печеночных синусоидов, – непаренхиматозные клетки печени. К ним относятся клетки Купфера, эндотелий синусоидов, клетки Ито (жиронакапливающие клетки) и pit-клетки.
Эту систему клеточных элементов, выстилающих капилляры печени и обеспечивающих гомеорезис, принято называть ретикулоэндотелиальной системой печени. Функционирование этой системы прямо зависит от микроэкологии толстой кишки и деятельности гепатоцитов.
Кратко охарактеризуем структурные и функциональные особенности ретикулоэндотелиальной системы печени.
На мембранах клеток Купфера и эндотелии синусоидов расположено множество разнообразных рецепторов, обеспечивающих поглощение и катаболизм широкого круга веществ, поступающих в печень из кишечника. Основными из них с позиций липидного дистресс-синдрома Савельева являются scavenger-рецепторы, осуществляющие быстрый захват и деградацию модифицированных липопротеидов низкой плотности (ЛПНП).
При высокой концентрации модифицированных ЛПНП моноциты содержат много эфиров холестерина и превращаются в "пенистые" клетки. В связи с этим устойчивость к гиперхолестеринемии прямо зависит от активности scavenger-рецепторов непаренхиматозных клеток печени.
Помимо непаренхиматозных клеток печени, в захвате и катаболизме липопротеидов участвуют и гепатоциты. На эндотелиоцитах кроме рецепторов к липопротеидам низкой плотности обнаружен рецептор для печеночной липазы, вырабатываемой самими гепатоцитами.
Благодаря такому содружеству липопротеиды сначала фиксируются к мембране эндотелиоцита, где под действием липазы распадаются, из них освобождаются холестерин и его эфиры, которые, прямо или предварительно пройдя через ретикулоэндотелиальную систему, попадают в гепатоциты.
Таким образом, удаление атерогенных фракций липопротеидов во многом зависит от функции печеночной ретикулоэндотелиальной системы, при блокаде которой нарушаются ее антилипидемические свойства.
Помимо этого рецепторопосредованного механизма элиминации липопротеидов из крови, существует другой, не менее интересный вариант поддержания липидного гомеостаза – "печеночное сито". "Печеночное сито" представляет собой фенестрированный эндотелий печеночных синусоидов, т.е. фильтр, отделяющий крупные хиломикроны, образующиеся в тонкой кишке, от их остатков, лишенных триглицеридов, но обогащенных холестерином.
От размеров и количества пор в сите зависит, какие липопротеиды поступят в пространство Диссе, будут "распознаны" рецепторами микроворсин гепатоцитов и затем превращены в антиатерогенную фракцию – липопротеиды высокой плотности.
С позиций клинической липидологии общепризнанные факторы риска атеросклероза (никотин, этанол, адреналин, норадреналин, серотонин и др.) уменьшают суммарную пористость эндотелия синусоидов, что приводит к прогрессированию дислипопротеидемии и липидного дистресс-синдрома в целом.
Таким образом, в регуляции липидного обмена ретикулоэндотелиальной системы печень играет далеко не последнюю роль.
Другой не менее важной функцией клеток ретикулоэндотелиальной системы является способность к выделению эндотелиоцитами факторов, регулирующих кровоток и свертывание крови. При повреждении клеточных элементов ретикулоэндотелиальной системы резко усиливается экспрессия фактора Виллебранда, что потенцирует агрегацию тромбоцитов и их адгезию к субэндотелиальному матриксу, т.е. потенцирует атерогенез.
Регуляция ретикулоэндотелиальной системы печени очень сложна, ее клетки легко переходят из одного функционального состояния в другое. Основной регуляторный механизм осуществляется путем примирования (кондиционирования) клеток Купфера. В реальной жизни в качестве примирующего стимула выступают липополисахариды эндотоксинов грамотрицательной микрофлоры толстой кишки.
Стимулированные эндотоксином клетки ретикулоэндотелиальной системы печени вырабатывают большое количество различных цитокинов. При этом происходит торможение активности монооксигеназ в гепатоцитах, нарушается сложная кооперация клеток ретикулоэндотелиальной системы с гепатоцитами, что в итоге приводит к замедлению гидролиза эфиров холестерина в печени и их выведения вместе с холестерином в желчь.
Повышенное поступление липополисахаридов эндотоксинов кроме непосредственного влияния на обмен холестерина опосредованно через ту же ретикулоэндотелиальную систему печени нарушает суммарный синтез белка гепатоцитами. При этом в них обнаруживаются поврежденные мембраны и дегенерация органелл.
Патология функции ретикулоэндотелиальной системы печени помимо метаболических изменений в гепатоцитах приводит к нарушению антивирусной активности купферовских клеток. Так, при гиперхолестеринемии антивирусная защита снижена во много раз по сравнению с нормолипидемией.
В связи с этим появившиеся в последнее время гипотезы "вирусного происхождения атеросклероза" по сути основаны на обнаружении вторичных, сопровождающих патологию ретикулоэндотелиальной системы и связанных с ее регуляцией причин и могут быть отнесены к модным научным спекуляциям.
Таким образом, синусоидальные клетки в своем взаимодействии связаны как структурно, так и функционально. Их функции, осуществляемые по принципу дублирования и взаимной поддержки, контролируют метаболизм липидов, белков, липопротеидов, биогенных аминов, цитокинов и т.д. Кооперативные связи синусоидальных клеток, определяющих внутрипеченочный гомеостаз, подчинены "обслуживанию" гепатоцита, осуществляющего основные специализированные функции печени.
Все сказанное наиболее ярко проявляется на примере дислипопротеидемий и обусловленных ими заболеваний, которые, несмотря на ежегодное появление на фармакологическом рынке новых препаратов и схем лечения, представляют по-прежнему сложную задачу.
Причина кроется в порочном методологическом подходе к лечению нарушений липидного обмена, не изменившемся за многие годы: кратковременная лекарственная терапия эффективными холестеринснижающими препаратами не способна за столь короткое время нормализовать морфофункциональные нарушения в органах-мишенях (артериях, печени, желчном пузыре и т.д.), с одной стороны, с другой – лечение только органа-мишени (к примеру, реконструктивно-восстановительные операции на артериях при атеросклерозе или холецистэктомия при желчнокаменной болезни) и неприятие патологии липидного метаболизма как метаболической проблемы всего организма, требующей длительного (иногда, пожизненного) лечения.
Оставаясь неустраненной, первопричина патологического процесса приводит к прогрессированию заболевания.
Вот почему ряд заболеваний, обусловленных нарушениями липидного метаболизма (облитерирующий атеросклероз артерий нижних конечностей и органов брюшной полости, липогенный панкреатит, холестероз желчного пузыря, желчнокаменная болезнь, жировой гепатоз и др.), по предложению акад. В.С.Савельева рассматриваются с позиции липидного дистресс-синдрома (ЛДС) – системной патологической реакции организма на основе нарушений липидного обмена в виде процессов, выходящих за рамки органа-мишени, способствующей возникновению новых или прогрессированию имеющихся заболеваний, и сопровождаются нарушениями различных функций печени, которая становится главным органом-мишенью.
Основную роль в развитии морфофункциональных изменений печени играет ее ретикулоэндотелиальная система, действующая в тесной кооперации с гепатоцитами и микрофлорой ЖКТ. Наиболее важным звеном патогенеза ЛДС являются изменения в системе хозяин – микробиота.
Усиленное размножение бактерий в подвздошной кишке (особенно анаэробов с их повышенной способностью деконъюгировать связанные желчные кислоты и формировать токсичные эндогенные соли желчных кислот) нарушает природный механизм холестеринового гомеостаза – энтерогепатическую циркуляцию желчных кислот, и способствует развитию в последующем большинства патологических изменений в печени и прогрессированию ЛДС Савельева.
Рассмотрим роль микрофлоры в обмене холестерина в организме более подробно.
Механизм холестеринового гомеостаза сложен, но пути реализации известны. Это в значительной степени зависит от количества и спектра стероидов, а также других липидов, входящих в состав пищи, интенсивности эндогенного синтеза холестерина, его абсорбции из пищеварительного тракта, деструкции и трансформации в другие соединения тканевыми и микробными ферментами, взаимоотношениями с желчными кислотами, интенсивности их печеночно-кишечной циркуляции, величины экскреции с фекалиями, гормонального статуса и т.д.
Здоровый человек ежедневно получает с пищей около 0,5 г животного холестерина и растительных (фитостеринов). Около 1 г холестерина в сутки синтезируется в клетках печени, кишечника, яичников, надпочечников, почек и аорты. В печени пищевой и эндогенный холестерин окисляется в желчные кислоты (до 1 г в сутки), здесь же образуются транспортные формы холестерина. На синтез стероидных гормонов ежедневно расходуется около 40 мг холестерина.
Пищевой и эндогенный холестерин в кишечнике частично реабсорбируется в виде хиломикрон, подвергаясь кишечно-печеночной рециркуляции. Остальная его часть (в нормальных условиях до 500–800 мг в сутки), происходящая из пищи, желчи, слущенного клеточного кишечного эпителия, выводится из организма в неизмененном виде (20–40%); в виде редуцированных микробными ферментами форм (60–80%) – копростанола, копростанона, холестенона, стигмастерола, кампестерола, бета-ситостерола, эпикопростанола, холест-4-ен-3-ола, ланостерина, дегидроланостерина, холест-7-ен-3-ола, метостерола и дальнейших продуктов их деградации.
С мочой ежедневно удаляется около 1–2 мг холестерина. У млекопитающих, включая человека, главным продуктом микробной трансформации является копростанол.
С 1935 г. существует гипотеза о том, что кишечная микрофлора участвует в холестериновом обмене. С тех пор накоплено много доказательств того, что резидентная и транзиторная микрофлора хозяина, синтезируя, трансформируя или разрушая экзогенные и эндогенные стерины, активно участвует в стериновом метаболизме.
К настоящему времени доказано, что микрофлора хозяина является важнейшим метаболическим и регуляторным органом, участвующем в кооперации с органами и клетками хозяина в поддержании гомеостаза холестерина и развитии гиперхолестеринемии.
Кишечная микрофлора препятствует абсорбции холестерина из пищеварительного тракта. Наличие в фекалиях копростанола рассматривается в качестве микроб-ассоциированной характеристики.
Первичным местом модификации молекулы холестерина является слепая кишка, это было доказано полным исчезновением копростанола после ее удаления. Подтверждение роли микрофлоры в сывороточном холестериновом гомеостазе было получено нами при операции парциального илеошунтирования.
Кишечные микроорганизмы не только разрушают, но синтезируют холестерин, интенсивность синтеза зависит от степени колонизируемости организма микробными штаммами.
Изменение липидного состава крови всегда отмечается на фоне глубоких микроэкологических нарушений в кишечнике. Они проявляются в виде повышенного количества аэробов, гемолитических кишечных палочек, стафилококков, грибов с одновременным снижением в фекалиях числа лакто- и бифидобацилл.
Многочисленными исследованиями доказано влияние антибиотиков на метаболизм холестерина.
Антибиотики, действующие преимущественно на грамположительную микрофлору, оказывают более действенное влияние на трансформацию холестерина в копростанол. Использование многих препаратов приводит к увеличению накопления холестрина в печени (стеатоз).
Патогенез гиперхолестеринемии с позиций микробиоты представляется следующим образом. Нагрузка экзогенным холестерином превышает компенсаторные возможности регуляторных механизмов этого стерина в организме. Повышается синтез холестерина клетками органов и тканей хозяина, нарушается транзит экзогенного и эндогенного холестерина по пищеварительному тракту и изменяется абсорбция холестерина и его производных из кишечника.
Нарушаются трансформации холестерина в желчные кислоты и стероидные гормоны, в неабсорбируемые формы нейтральных стеринов или деструкции стеринов до конечных продуктов. Все это сопровождается усиленным синтезом холестерина микроорганизмами хозяина и нарушением процессов включения холестерина в мембраны клеток организма и микроорганизмов.
Клетки кишечника не только синтезируют холестерин, но и продуцируют соединения, регулирующие его синтез в печени. Эти соединения (преимущественно белковой природы) оказывают как прямое воздействие на клеточный синтез холестерина, так и опосредованно, влияя на образование в печени желчных кислот.
Снижение в просвете кишечного тракта холестерина и желчных кислот индуцирует образование особых веществ, которые через портальную циркуляцию стимулируют печеночный холестериногенез или превращение холестерина в другие биологически активные стерины, прежде всего желчные кислоты.
Кишечные микроорганизмы, проявляя протеолитическую, гидролитическую или иную биохимическую активность, способны либо модифицировать синтез регуляторных соединений, либо деградировать их, тем самым косвенно изменяя образование в печени холестерина и желчных кислот.
Микроорганизмы пищеварительного тракта вмешиваются в холестериновый метаболизм, воздействуя непосредственно на ферментные системы клеток хозяина, синтезирующих эндогенный холестерин. Так, бифидобактерии уменьшают выход холестерина из гепатоцитов за счет ингибирования активности ГМГ-КоА-редуктазы.
Некоторые штаммы кишечных стрептококков усиливают катаболизм холестерина в желчные кислоты. Различные компоненты микробной клетки (эндотоксин, мурамидипептиды, зимозан), гамма-интерферон и другие соединения микробного происхождения или те, синтез которых связан с микроорганизмами, способны индуцировать повышенный синтез холестерина в различных клетках макроорганизма, в особенности у лиц, склонных к гиперхолестеринемии.
Главным предшественником эндогенного холестерина является ацетат, его образование в значительной степени связано с ферментацией анаэробами микроаэрофильными бактериями кишечника различных углеродсодержащих бактерий. Образующийся в толстой кишке при анаэробной ферментации углеводов и жиров пропионат способен снижать уровень холестерина в сыворотке крови за счет ингибирования синтеза этого стерола гепатоцитами.
Любые вмешательства, затрагивающие состав анаэробных бактерий, изменяют пул ацетата, пропионата и других летучих жирных кислот в организме хозяина и как следствие количество синтезируемого клетками холестерина.
Кроме печени важным источником эндогенного холестерина являются клетки ворсинок кишечника. Бактерии, присутствующие в пищеварительном тракте, оказывают существенное влияние на скорость обновления кишечного эпителия и, следовательно, также регулируют образование эндогенного холестерина.
Содержание холестерина в сыворотке крови зависит от выраженности его абсорбции из кишечника. Последняя связана со скоростью транзита нейтральных стеринов через кишечник, концентрацией в кишечном содержимом ионов (прежде всего ионов кальция), наличием и степенью сродства рецепторов кишечника к липопротеинам или микроорганизмам, участвующим в трансформации холестерина.
Кишечные микроорганизмы, влияя на указанные функции, вмешиваются в регуляцию концентрации холестерина в сыворотке крови и печени.
Многие кишечные бактерии активно деконъюгируют желчные кислоты. Свободные желчные кислоты уменьшают абсорбцию из кишечника холестерина. В зависимости от количественного содержания в просвете кишечника летучих жирных кислот, образуемых бактериями при анаэробном метаболизме углеводов, жиров, абсорбция катионов кальция, магния и цинка изменяется в широких пределах, что косвенно отражается на уровне холестерина в крови.
Длительное время считалось, что основным путем превращения холестерина в организме является его окисление (как циклического ядра, так и боковых цепей), катализируемое цитохромом Р-450 клеток хозяина. Но катаболизм холестерина осуществляется также ферментными системами многочисленных микроорганизмов, при этом скорость и глубина микробной трансформации зависит от количественного и качественного состава аэробных и анаэробных бактерий, степени анаэробиоза, источника углерода, концентрации в кишечном содержимом желчи, антимикробных агентов и многих других факторов.
При этом редукция холестерина гидрогеназной системой бактерий толстой кишки идет с образованием не только копростанола, но и других несорбируемых нейтральных стеринов.
Рассматривая роль микроорганизмов в регуляции пула холестерина в организме человека, необходимо иметь в виду, что кишечные и другие бактерии способны помимо холестерина вызывать деструкцию и трансформацию желчных кислот и стероидных гормонов.
Ввиду тесной метаболической взаимосвязи стероидов этих трех групп (холестерина, желчных кислот и стероидных гормонов) изменение концентрации одного из этих соединений индуцирует или ингибирует синтез холестерина.
Холестерин входит в состав мембран не только макроорганизма, но и бактерий; с учетом видового и количественного состава бактерий в организме хозяина количество холестерина, связываемого микроорганизмами, различается, что отражается на пуле свободного холестерина в сыворотке крови.
Некоторые бактерии обладают способностью полностью деструктурировать холестерин благодаря ферментативным системам. Некоторые из микробов являются постоянными или транзиторными обитателями кожи и слизистых оболочек человека. Превращение холестерина в воду и углекислый газ идет с образованием до 17 промежуточных метаболитов. Другим вариантом деградации холестерина является образование как воды и углекислого газа, так уксусной и пропионовой кислот.
Многие аэробы способны разрушать только боковые цепи молекулы холестерина, а другие только деградируют промежуточные продукты метаболизма холестерина. При этом достигается до 93% деградации стероида.
В ряде случаев микробы образовывают соединения, модифицирующие синтез стероидов, а также являются носителями генов ДНК, кодирующих продукцию холестериноксидазы.
На примере исследования около 5000 штаммов кишечных палочек было установлено, что холестеринразрушающей способностью обладали 40% бактерий, холестеринмодифицирующей – 28%, холестеринсинтезирующей – 32% культур.
Микроорганизмы, связывающие холестерин, сорбируют различные жирные кислоты (пальмитиновую, олеиновую и др.). Многие бактерии способны ассимилировать холестерин в присутствии желчи при более низких рН среды (<6,0). Конъюгированные и неконъюгированные желчные кислоты различным способом влияли на процесс ассимиляции холестерина бифидобактериями.
В основе гипохолестеринемического эффекта бифидобактерий бифидогенных агентов (олигосахаридов) у больных лежит снижение рН толстой кишки, обусловленное ферментацией полисахаридов. При низких значениях рН подавляется бактериальная деградация первичных желчных кислот, что ведет к изменению их кишечно-печеночной циркуляции и как следствие подавлению синтеза жирных кислот в печени. Это ингибирует образование в печени холестерина и снижает уровень плазменного холестерина.
Существует и другая точка зрения на механизм снижения холестерина. Холестерин и желчные кислоты легко преципитируют. Чем ниже рН среды, тем больше формируется копреципитатов холестерина и желчных кислот. Уменьшение в среде концентрации холестерина в присутствии лактобацилл обусловлено не ассимиляцией холестерина бактериями, а способностью последних вызывать деконъюгация желчных кислот, связывающих холестерин при низких значениях рН.
Усиленное размножение бактерий (особенно анаэробов) в тощей кишке приводит к развитию патологических изменений в печени (стеатоз) в связи с их повышенной способностью деконъюгировать связанные желчные кислоты и формировать токсические эндогенные соли желчных кислот.
Лечебные воздействия необходимо ориентировать по 4 основным направлениям: нормализации липидного метаболизма; восстановлению нарушенных метаболических функций печени; активизации функций ретикулоэндотелиальной системы; устранению дисбиоза толстой кишки. Все они в равной степени важные и выделить какое-то одно из них невозможно из-за тесной метаболической кооперации всех этих нарушений.
В связи с этим применение большого количества препаратов нецелесообразно и небезопасно, особенно явно это прослеживается при использовании препаратов, блокирующих синтез холестерина в печени. Ее нарушенные ферментативные системы, разбалансированность механизма контроля их функций вследствие изменения кооперации в системе микробиота – ретикулоэндотелиальная система – гепатоцит, не оставляют надежд на достижение положительного метаболического эффекта.
В решении этой проблемы мы выделяем три кардинальные задачи – восстановление процессов синтеза желчи в печени и ее поступления в кишечник, активизацию ретикулоэндотелиальной системы печени и нормализацию микробиоценоза кишечника. Они успешно реализуются при длительном использовании растительных комбинированных гепатопротекторов, нового уникального активного энтеросорбента ФИШант-С и пробиотиков. Комплекс этих препаратов отличается абсолютным отсутствием гепатотоксического эффекта, что очень важно со всех позиций.
Клиническая эффективность и абсолютное отсутствие осложнений при лечении масляно-пектиновой эмульсией ФИШант-С (разрешение МЗ РФ №005469) объясняется, с одной стороны, ее нейтральными для организма компонентами (белое масло, пектин и агар-агар), а с другой – способностью восстанавливать нарушенный физиологический баланс холестерина при помощи блокады энтерогепатической циркуляции желчных кислот, активной энтеросорбции экзогенных токсинов и эндотоксина и нормализации микробиоценоза кишечника.
Ее компоненты не всасываются в ЖКТ и инертны с химической точки зрения. ФИШант-С представляет новый класс лечебных средств в виде сложной активной многокомпонентной микроэмульсии (размер мицеллы около 0,1 мкм), термодинамически устойчивой в кислой и щелочной средах, обратимой в присутствии желчных кислот, которая не участвующей в метаболизме; не всасывающейся в ЖКТ; имеющей высокую поверхностную энергию; структурную упорядоченность; определенную ориентацию и организацию надмолекулярных образований.
Абсолютно нейтральный для организма, не всасывающийся при транзите по ЖКТ и хорошо эвакуирующийся из него, не токсичный, не травмирующий слизистые оболочки, не изменяющий рН химуса и среды нахождения, не нарушающий метаболизм организма.
ФИШант-С обладает свойствами "активного" энтеросорбента, активизирует и восстанавливает многочисленные метаболические процессы.
Механизмы действия ФИШант-С: избирательная активная энтеросорбция и транспорт токсинов, ферментов, солей тяжелых металлов, регуляторных пептидов, простагландинов, серотонина, гистамина и т.д; активизация всасывательной способности слизистых оболочек кишечника путем имитации пищевой эмульсии и увеличения площади всасывания; дозированное раздражение рецепторных биологически активных зон кишечника; усиление метаболических процессов за счет иммобилизации ферментов; усиление метаболической активности ферментов и микроорганизмов ЖКТ; сохранение устойчивости химуса как дисперсной системы (коллоидный протектор), структурирование и гомеостазирование химуса; блокада энтерогепатической циркуляции желчных кислот и нормализация липидного метаболизма.
Для коррекции нарушений функций печени при ЛДС применяют препараты, относящиеся к группе гепатопротекторов. Они инициируют восстановление физиологических функций гепатоцитов и обладают мембраностабилизирующей и антиоксидантной активностью. Все гепатопротекторы в зависимости от ведущего механизма действия разделяются на препараты, усиливающие продукцию желчи (холеретики) и обеспечивающие достаточное поступление желчи из желчного пузыря и печени в процессе пищеварения (холекинетики).
Для нормализации функций печени при лечении ЛДС применяют комбинированные препараты только растительного происхождения!
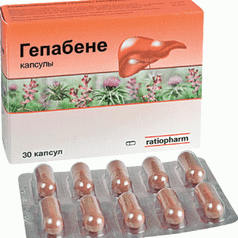
Одним из представителей комбинированных гепатопротекторных средств растительного происхождения является препарат “Гепабене”, в одной капсуле которого содержится 275 мг экстракта Fumaria officinalis (дымянки лекарственной) и 70–150 мг экстракта Fructus Sylibi mariani (плоды расторопши пятнистой) – 50 мг силимарина и 22 мг силибинина.
При длительном лечении нарушений функций печени при ЛДС независимо от органа-мишени целесообразно использовать гепатопротекторы, в состав которых включен силимарин, входящий в группу флавонолигноидов и состоящий из силибинина, силимарина и силикристина.
Механизм действия силимарина основан на защите мембран гепатоцитов от воздействия токсинов, повышении обезвреживающей функции гепатоцитов, антиоксидантном и антифибротическом эффекте, повышении белково-синтетической функции гепатоцитов, ингибировании синтеза холестерина в результате снижения активности микросомальной гидрооксиметил-КоА-редуктазы и т.д.
Использование гепабене в комплексной терапии ЛДС позволяет увеличить холерез за счет независимой от количества синтезируемых желчных кислот фракции, активизировать синтез эндогенного холецистокинина и секретина, что в результате увеличения секреции воды и бикарбонатов эпителием желчных протоков способствует восстановлению моторно-эвакуаторной функции желчного пузыря, снижению нейрогенного тонуса сфинктера Одди, обеспечивая большее поступление желчи в кишечник и создавая все метаболические условия для нормализации механизма энтерогепатической циркуляции желчных кислот и пищеварения.
Для нормализации микробиоценоза толстой кишки широко используют препараты на основе живых микроорганизмов (пробиотики). Пробиотики – это живые или убитые микроорганизмы либо вещества микробного происхождения (структурные компоненты, метаболиты), при приеме внутрь благоприятно влияющие на физиологические функции и биохимические реакции через оптимизацию микробиологического статуса.
Пробиотики на основе компонентов микробных клеток или метаболитов вмешиваются в метаболическую активность соответствующих органов и тканей либо непосредственно, либо опосредованно через регуляцию функционирования биопленок на слизистых оболочках.
Наиболее важными для слизистой оболочки кишечника специфическими функциями микроорганизмов являются продукция питательных субстратов жирных кислот (прежде всего летучих жирных кислот), аминокислот типа аргинина, глутамина и цистеина, а также витаминов, антиоксидантов и аминов, имеющих значимость для нормального функционирования всего организма.
Механизмы положительного эффекта пробиотиков: ингибирование роста потенциально патогенных микроорганизмов в результате продукции антимикробных субстанций; конкуренция с ними за рецепторы адгезии и питательные вещества; активация иммунокомпетентных клеток и стимуляция иммунитета; стимуляция роста индигенной флоры; нормализация рН, нейтрализация токсинов; восстановление и оптимизация функционирования биопленки слизистой оболочки кишечника; изменение микробного метаболизма, ведущее к повышению или снижению синтеза и активности бактериальных ферментов и как следствие продукции соответствующих метаболитов (летучих жирных кислот, глутамина, аргинина, витаминов, пептидогликанов и др.), оказывающих местное и системное воздействие на метаболическую активность различных органов и тканей, модулирующих морфокинетические и физиологические функции и биохимические реакции.
Хилак форте является уникальным пробиотиком, имеющим хорошую клиническую репутацию, применяется для лечения дисбиоза при ЛДС в составе комплексной терапии. Стерильный концентрат продуктов жизнедеятельности грамположительных и грамотрицательных микроорганизмов – симбионтов тонкой и толстой кишки, образующих молочную кислоту, аминокислоты, лактозу, короткоцепочечные жирные кислоты. Хилак форте содержит метаболические продукты лактобацилл, кишечной палочки и молочную кислоту.
Препарат создает оптимальную внутреннюю среду (рН) в кишке, оказывает прямое и быстрое действие при любом состоянии микрофлоры кишки, совместим с приемом антибиотиков, способствует быстрому восстановлению индигенной флоры, а также поддержанию физиологической функции слизистой оболочки.
При дисбиозе, обусловленном синдромом избыточного бактериального роста, эффективно использование пробиотика хилак форте в больших дозах (бактериостатический эффект).
Микроэкологические нарушения толстой кишки, протекающие без синдрома избыточного бактериального роста, могут быть устранены с помощью стандартных доз этого пробиотика. При назначении хилак форте целесообразно исследовать содержание летучих жирных кислот в фекалиях.
Применение пробиотика хилак форте способствует специфическому росту необходимых бактерий, нормализации микробиоценоза, положительным образом влияя на содержание ЛЖК и активность бактериальных ферментов.
Рациональный подход к лечению патологических изменений микрофлоры, осуществляемый в поддержке роста существующей кишечной флоры, физиологически адекватной организму человека, и подавлении патологических штаммов, способен нормализовать эти нарушения, стабилизировать течение ЛДС Савельева, т.е. уменьшить прогрессирование патологических изменений в органах-мишенях.