Микрофлора кишечника и состояние кожи
Стрессовые отклонения от режима рационального питания детей все чаще приводят к нарушению обменных процессов в кишечнике, которые вместе с другими факторами способствуют возникновению атопического дерматита или в экстремальной ситуации язвенного некротического энтероколита.
Последнее заболевание в своей этиологии связано с избыточным ростом в кишечнике клостридий перфрингенс, хеликобактера и особенно стрептомицетов, токсическое действие которых оправдывает его название.
Атопический дерматит является ярким примером связи состояния кожных покровов с микрофлорой кишечника. Обследование методом ГХ-МС микробных маркеров пятидесяти детей в возрасте от одного месяца до 12 лет (совместно с Мазитовой Л.П. и Текучевой Л.В., ЦНИКВИ им. Короленко) выявило систематический избыточный рост в тонком кишечнике эубактерий, клостридий перфрингенс, клостридий дефициле и стрептомицетов, а также превотелл, сфингомонад, энтеробактерий, пропионобактерий, стафилококков, бацилл, анаэробного пептострептококка, хеликобактера.
В статистической матрице они дают желтые полосы напротив соответствущих микроорганизмов по всей ее ширине. Отдельными ячейками выделены эпизодические сопутствующие микроорганизмы. В некоторых случаях концентрация микроорганизмов у больных ниже нормы – соответствующие ячейки в матрице помечены бирюзовым цветом. При этом суммарная концентрация микроорганизмов во всех случаях выше нормы
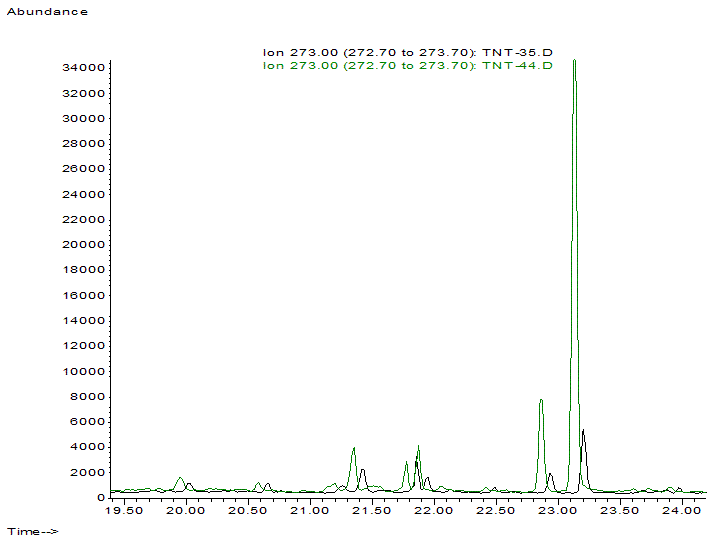
Рис. 5. Хроматографические пики маркеров Clostridium perfringens (10-гидрокси-олеиновой и 10-гидрокси-стеариновой кислот – два пика справа) существенно выше у детей с атопическим дерматитом (зеленая, верхняя хроматограмма) по сравнению со здоровыми (нижняя, черная хроматограмма).
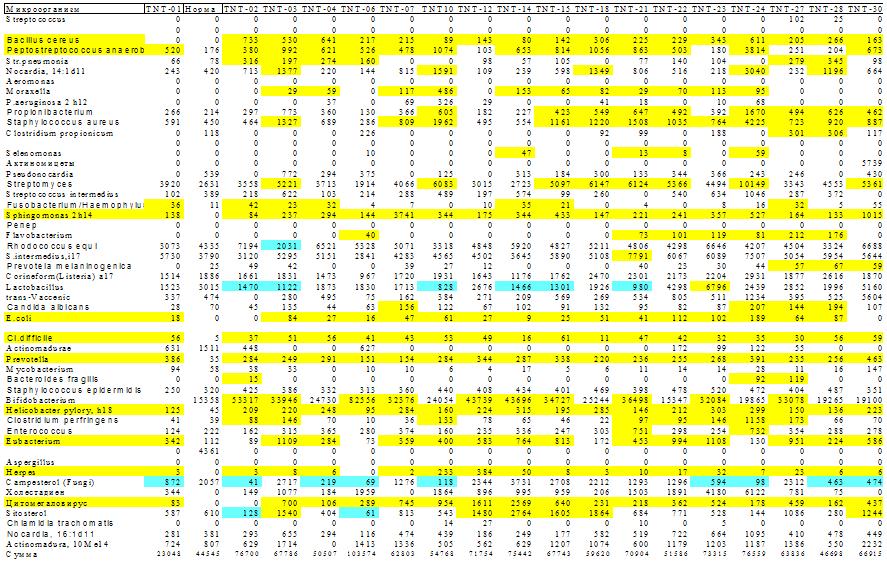
Рис 6. Микробная матрица при атопическом дерматите. Много микробов приобретают клинически значимые концентрации у всех больных. Кроме того, много частых сопутствующих микроорганизмов. Возможно, с этим связана атопика - неопределенность локализации и характера клинических проявлений. Матрица полосато-пятнистая: полосы – избыточный рост микробов, специфичных для данного заболевания. Пятна – эпизодический избыточный рост микробов у части пациентов.
Специфика микробной матрицы при АД состоит в том, что хотя многие микробы приобретают клинически значимые концентрации у всех больных, наблюдается много частых появлений сопутствующих микроорганизмов. Возможно, с этим связана атопика - неопределенность локализации и характера клинических проявлений этого заболевания.
Результаты исследования изменений состава микроорганизмов в кишечнике при атопическом дерматите свидетельствуют, что здоровье кожи напрямую связано с его стабильностью. Что является первичным, а что вторичным в этом взаимоотношении еще предстоит выяснить. Тем не менее, ясно, что нормализация кишечного биоза может облегчить лечение заболевания.
Себорейный дерматит (себорея)
Впоследствии было найдено, что и при других кожных заболеваниях происходят изменения в составе микробиоты тонкого кишечника. В стадии завершения работа по себорейному дерматиту (совместно с акад. Учайкиным В.Ф. и кмн Полеско И.В., РГМУ). Это распространенное заболевание сопровождается иными изменениями кишечной микрофлоры, чем при атопическом дерматите, но также одинаковым у исследованной группы пациентов.
При себорее тоже растет численность аэробных актиномицетов, но уже не стрептомицетов, а псевдонокардий, родококков и других. Тоже повышается концентрация клостридий, но не перфрингенс, а других: видов рамозум, пропионикум и гистолитикум. Одновременно уменьшается численность эубактерий, бифидобактерий и лактобацилл.
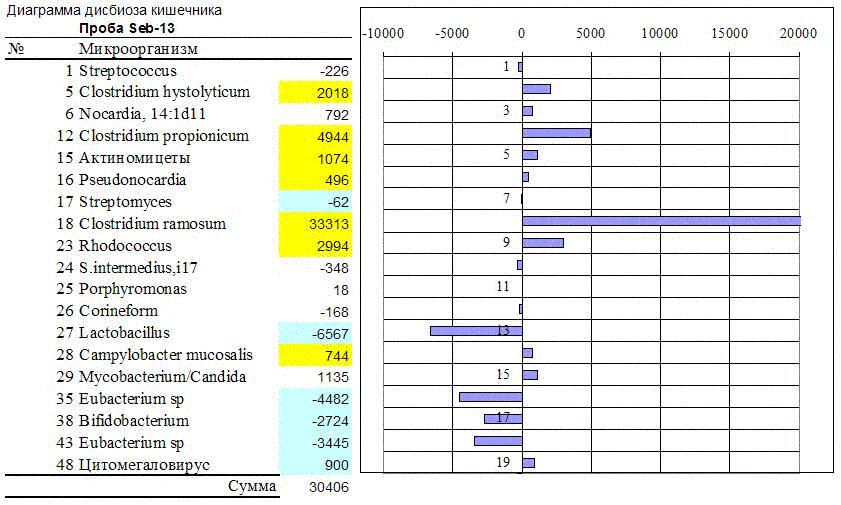
Рис. 7. Диаграмма и таблица изменений численности части микробиоты кишечника, типичных для себореи.
Угревая болезнь (акне)
Это распространенное в молодом возрасте заболевание имеет общие корни с себореей, связано с изменением функции сальных желез и сопутствующем изменением микрофлоры кожи. Основными бактериальными агентами акне и себореи считаются микроскопические грибы рода Malassesia, бактерии Propionibacterium acnes и стафилококки.
Метод ГХ-МС позволил подтвердить и расширить список микроорганизмов кожи, участвующих в процессе заболевания, а также обнаружить систематические изменения состава микрофлоры кишечника, сходные у обследованных больных (совместно с проф. Самсоновым В.А. и аспирантом Кабаевой Т.И., ЦНИКВИ им Короленко). Действительно, при акне кроме малассезии в коже наблюдается усиленный рост и других микроскопических грибов: кандиды и группы не идентифицированных, но обнаруженных по продукции специфических стеролов – кампестерола и ситостерола.
Кроме P.acnes, микроба, видовое определение которого стало названием заболевания, найдены маркеры пропионовых бактерий других видов и морфологически сходных с ними коринебактерий и актиномицетов, которые в сумме также обнаруживают избыточный рост на коже больных. Аналогичным образом оказалось, что стафилококки не являются единственным представителем кокковых форм при акне. К ним следует добавить стрептококки и руминококки.
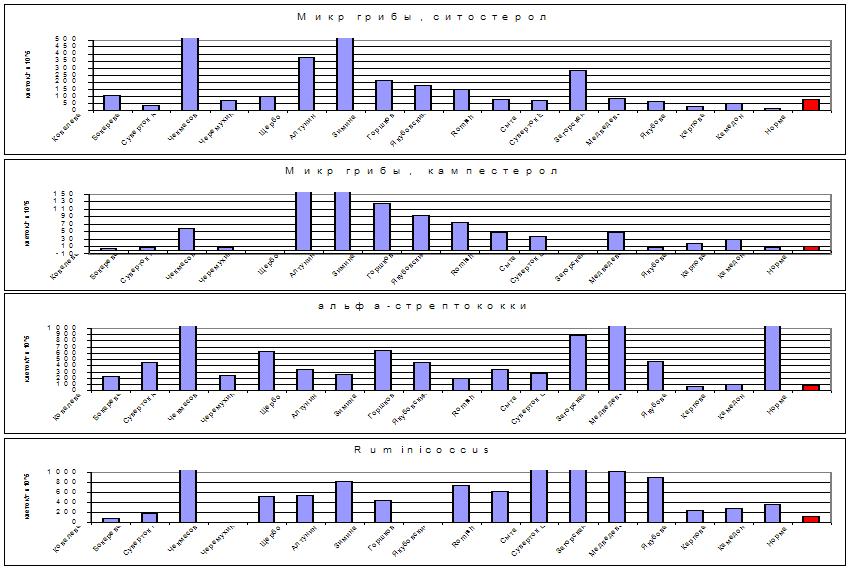
Рис. 8. Избыточный рост микроскопических грибов,
альфа-стрептококков и руминококков на коже ряда больных
акне в сравнении с нормой (красный столбик справа).
Для акне, по данным исследования микробных маркеров в крови, в кишечнике специфичен избыточный рост клостридий, бацилл, хеликобактера, некторых актиномицетов и Eubacterium lentum при дефиците других (основных) видов Eubacterium, лактобацилл и коринебактерий. Метод ГХ-МС в современном исполнении обладает способностью разделять сложные органические смеси и одновременно идентифицировать вещества по их масс-спектрам.
С его помощью в кожном сале было выявлено 123 составляющих компонента из числа жирных кислот, спиртов и стеролов, входящих в состав восков (эндогенных липидов кожи) и эфиров холестерина, проникающих из кровяного русла и рассматриваемых в патологии акне в качестве экзогенных липидов, способствующих развитию заболевания. К этому следует добавить пул липидных компонентов микроорганизмов, населяющих кожу – еще около 70 микробных жирных кислот, оксикислот и стеринов.

Рис 9. Матрица кожного сала (себума) у больных угревой болезнью. 118 жирных кислот (верхняя половина таблицы) и спиртов (нижняя половина) двадцати пациентов расположены сверху вниз по мере увеличения длины цепи молекулы. Желтым цветом выделены ячейки с превышением нормы в два и более раз. Бирюзовым – уменьшение более чем в два раза. Концентрация бирюзового цвета к низу матрицы показывает уменьшение доли длинноцепочечных молекул спиртов и жирных кислот, а также преимущественное уменьшение доли спиртов в кожном сале.
Таким образом, в распоряжение дерматолога предоставляется еще одна матрица, показывающая статистику изменения состава веществ кожного сала при заболевании в сравнении с нормой. Эти данные, наряду с морфологическими и физиологическими характеристиками измененной кожи помогут понять причину заболевания и наметить пути эффективного лечения.
Пока можно отметить, что эти данные подтверждают известное уменьшение доли эндогенных липидов (восков) при угревой болезни, а также выявляют новые детали изменений в себуме: уменьшение доли длинноцепочечных жирных кислот и спиртов, существенное снижение содержания специфической кожной ЖК – себолеата и другие.
Алопеция
При алопеции микробное сообщество кожи равно как и микробиота кишечника претерпевают существенные изменения. Лидерство в избыточном росте на коже приобретают анаэробы (клостридии группы гистолитикум, анаэробные пептострептококки, бактероиды) и микроскопические грибы, продуцирующие кампестерол или ситостерол.
К ним присоединяются уже упоминавшиеся в связи с акне альфа-стрептококки, коринебактерии, стрептомицеты и пропионобактерии. Изменение численности микроорганизмов в зоне сальных желез составляет величину от 10 до 1000 крат.
Разумно предположить, что это обстоятельство препятствует росту волос, поскольку морфологические изменения в коже приписывают в основном воспалительным процессам. Последние, как правило, связывают с наличием инфекции или избыточной колонизацией автохтонной микрофлорой.
При алопеции в кишечнике большинства обследованных обнаруживается избыточный рост суммарной микробиоты, преимущественно за счет микроскопических грибов, продуцирующих кампестерол, эубактерий, бактероидов, клостридий, стрептококков и некоторых актиномицетов.
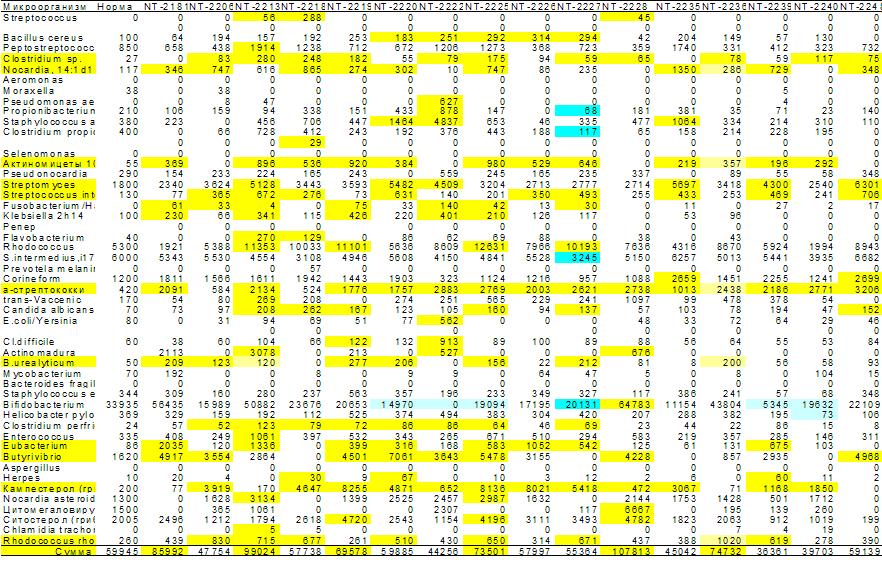
Рис.10. Микробная матрица дисбиоза кишечника при алопеции. Желтые полосы относятся к постоянным у разных пациентов увеличениям концентрации в пристеночном слое тонкого кишечника микроскопических грибов, эубактерий, бактероидов, клостридий стрептококков и актиномицетов при суммарном избыточном росте кишечной микрофлоры.
Что из этого следует?
Следует жить. Жить в плодотворном союзе с микроорганизмами, как это и происходит на протяжении более миллиона лет. Микробное сообщество в составе муцинового геля слизистых оболочек представляется в виде многоклеточной псевдоткани (биопленки) и является жизненно важным органом человека.
Как показывают приведенные здесь примеры состав микроорганизмов биопленки постоянен у здоровых людей и изменяется при патологических состояниях. Как следствие изменяется доля участия микроорганизмов в физиологических процессах на слизистых оболочках или коже организма-хозяина.
Возникает дисбаланс в снабжении других органов зависимыми от микробов веществами, нарушается гомеостаз метаболических процессов, стабильность иммунной системы. Если возмущение превосходит компенсаторные ресурсы организма происходит не предсказуемый пока каскад нарушений физиологических, биохимических и иммунных процессов с клинически очевидными последствиями.
Как оказывается, кишечные, кожные, кардиоваскулярные, мочеполовые и другие заболевания причинно-следственно связаны с изменением микрофлоры местной локализации и кишечной, как депо микроорганизмов в теле человека. Данные молекулярных методов, в том числе и масс-спектрометрия микробных маркеров, полученные в конце ХХ века, заставляют по-новому отнестись к регулированию взаимоотношений хозяина с собственной микрофлорой.
Концепция моноэтиологичности заболеваний микробного происхождения, деление микробов на патогенные и непатогенные должны быть пересмотрены. Все микробы, обитающие в организме человека, одновременно пребывают в этих двух ипостасях. Любой из них может быть причиной воспалительных процессов.
Даже, казалось бы, святые лактобациллы и бифидобактерии оказываются причиной, например, гнойничковых поражений кожи промежности. Исключение составляют лишь агенты особо опасных инфекций, возбудители чумы, холеры, сибирской язвы и других. Хотя есть и «исключения из исключений» например, носительство возбудителей бруцеллеза или туберкулеза.
Самый парадоксальный случай – возбудитель смертельно опасного заболевания – газовой гангрены – Clostridium perfringens является одним из самых распространенных видов микроорганизмов толстого кишечника и фекалий.
Должна быть пересмотрена и концепция антибиотикотерапии. Ее фундамент – микробная моноэтиологичность и резистентость штаммов к антибиотикам в монокультуре in vitro – не адекватны форме существования микробного сообщества человека в норме и патологии.
То же самое относится и к пробиотикотерапии которая в основном базируется на представлении о доминирующей роли бифидобактерий в микробиоте кишечника. В результате из поля зрения микробиолога, врача и биотехнолога выпадают эубактерии, клостридии и актиномицеты, которых в кишечнике по современным оценкам на порядок больше, чем бифидобактерий. Однако такие перемены в умах и традициях требуют времени.
Что можно извлечь сейчас из результатов молекулярных исследований для пользы пациента? Пока лечение по данным панорамного анализа микроэкологического статуса организма в целом (по маркерам в крови) и в биологических жидкостях локусов в стадии освоения несколькими врачами разных специальностей в Москве и некоторых городах России.
Стабильные результаты получены в гинекологии. Обнадеживает проступающая при статистической обработке данных тенденция к нозологической специфичности изменений микрофлоры кишечника и локуса. Иначе говоря, для каждого заболевания характерны сходные у разных пациентов изменения микрофлоры как в очаге воспаления, так и в кишечнике.
Если это подтвердится, то уже в скором времени стандартное лечение можно будет назначать по клиническому диагнозу, если нет возможности провести подробное микроэкологическое обследование. Но при этом потребуется освоить новую лечебную квалификацию: специалиста по коррекции дисбиозов.
Вернуться к части 2...
Вернуться к началу статьи - части 1...
Источник: https://disbak.ru/nauchnye-publikatsii/nevidimyy-organ-mikroflora-cheloveka-chast-3.html
© ГастроПорта