Под термином “дисбактериоз кишечника” понимают изменения в микрофлоре, возникающие под влиянием самых разнообразных факторов [1]. Как известно, в кишечнике человека содержится около 500 видов микроорганизмов, общее количество которых достигает 1014, что даже превышает общую численность всех клеток организма человека [2].
Естественно, что изменения в составе микробной флоры кишечника, качественные и/или количественные, не могут пройти бесследно для функционального состояния этой важнейшей системы организма и не могут не отразиться на состоянии организма в целом. Поэтому не случайно, что к проблеме дисбактериоза кишечника в течение многих десятилетий приковано внимание исследователей самых различных специальностей.
Впервые понятие “дисбактериоз кишечника” появилось в начале XX века, точнее в 1916 г., в период бурного развития микробиологии. Оно было предложено A.Nissle [3] как обозначение появления в кишечнике человека под влиянием неблагоприятных факторов (в основном кишечных инфекций) “неполноценных” штаммов кишечной палочки, в отличие от “полноценных”, свойственных здоровым людям.
Для “полноценных” штаммов было характерно наличие выраженной антагонистической активности по отношению к возбудителям кишечных инфекций. Позже, в 50-х годах прошлого столетия, А.Nessle [3], Л.Г.Перетц [4, 5] и другие исследователи [1, 6, 7] расширили это понятие.
Под кишечным дисбактериозом стали подразумевать изменение кишечной микрофлоры, характеризующееся снижением общего количества типичной кишечной палочки (с нормальной ферментативной и антагонистической активностью), бифидобактерий и лактобактерий и появлением лактозонегативных эшерихий, гемолизирующих кишечных палочек, увеличением количества гнилостных, спороносных, гноеродных и других бактерий.
Значительно расширилось представление о перечне разнообразных факторов, обусловливающих развитие дисбактериоза кишечника.
Во-первых, не только кишечные инфекции являются причиной возникновения этого состояния, но практически все воспалительные заболевания слизистой оболочки кишечника инфекционной и неинфекционной природы могут вызвать дисбактериоз.
Здесь особо следует отметить аллергическое поражение слизистой оболочки кишечника, аутоиммунные заболевания, ферментопатии и необластические процессы. Более того, длительно сохраняющиеся функциональные расстройства желудочно-кишечного и желчевыделительного трактов также способны стать причиной изменения микробиоценоза кишечного содержимого.
Во-вторых, состав микрофлоры кишечника может существенно меняться под влиянием новых условий обитания и питания пациента, а также под влиянием воздействия экологически неблагоприятных факторов внешней среды, тяжелых заболеваний других органов и систем и избыточных физических и психических нагрузок, т.е. под влиянием факторов, которые рассматриваются в качестве стрессовых воздействий на организм.
Ярким примером этого являются изменения биоценоза кишечника в условиях космических полетов, когда параллельно длительности космического полета у космонавтов отмечаются нарастающие изменения микрофлоры кишечника вплоть до появления гноеродных бактерий [1, 6, 7].
Но особо неблагоприятное воздействие на микробиоценоз кишечника оказывает длительная и интенсивная антибактериальная терапия, которая способна вызывать тяжелейшие изменения микробиоценоза вплоть до полного исчезновения нормальной микрофлоры, что в свою очередь обусловливает бурное размножение нетипичной для кишечника микрофлоры, повышение ее вирулентности и развитие вследствие этого антибиотико-ассоциированного воспалительного поражения кишечника.
Наконец, следует помнить о возрастном факторе. Давно отмечено, что кишечный дисбактериоз особенно легко возникает в старческом и детском возрасте. В старческом возрасте возникновение дисбактериоза обусловлено самим старением организма, ослаблением ферментативной и иммунологической активности слизистой оболочки кишечника, возрастным изменением образа жизни и питания.
В детском возрасте склонность к более быстрому и легкому развитию кишечного дисбактериоза связана прежде всего с ферментативной, иммунной и двигательной незрелостью кишечника, во-вторых, с более частыми острыми инфекционными заболеваниями, особенно свойственными раннему детскому возрасту.
При них желудочно-кишечный тракт (ЖКТ) так или иначе вовлекается в общий инфекционный процесс, а в лечении часто используются антибиотики. В-третьих, в детском возрасте микроэкологическая система кишечника переживает период становления и адаптации к расширяющейся пищевой нагрузке. Это делает саму микроэкологическую систему нестабильной и особо уязвимой по отношению к воздействию неблагоприятных факторов.
В то же время роль нормального биоценоза кишечника чрезвычайно велика и многообразна [5, 6].
Во-первых, в силу своих антагонистических по отношению к патогенным кишечным микроорганизмам свойствам нормальная кишечная микрофлора является одним из основных факторов противоинфекционной защиты организма.
Во-вторых, нормальная микрофлора способствует образованию короткоцепочечных жирных кислот, которые, являясь основными энергоносителями, обеспечивают нормальную трофику слизистой оболочки кишечника, снижают ее проницаемость по отношению к различным антигенам.
Ферменты нормальной микрофлоры участвуют в деконъюгации желчных кислот, преобразовании первичных желчных кислот во вторичные, большая часть из которых реабсорбируется, а меньшая (приблизительно 5–15%) определяет уровень гидратации кала и соответственно нормальный транзит каловых масс по кишечной трубке и адекватный акт дефекации.
Избыточное микробное обсеменение тонкой кишки, свойственное дисбактериозу, способствует преждевременной и избыточной деконъюгации желчных кислот и вызывает разжижение стула (секреторная диарея).
Хотелось бы подчеркнуть, что нормальная микробная флора кишечника весьма различается в различных его отделах [2, 5, 6]. Большая часть микроорганизмов сосредоточена в пристеночном слое кишечника. Здесь их концентрация достигает 1011 кл/г, что на несколько порядков выше, чем концентрация микроорганизмов в полости кишечника.
Причем в различных отделах кишечной стенки концентрация и видовая характеристика микробного пейзажа различны [2]. Очевидно, что видовое разнообразие пристеночной микрофлоры значительно варьирует на протяжении кишечника и существенно отличается от состава микрофлоры фекалий.
В полостном содержимом тощей кишки основными видами микроорганизмов являются стрептококки (в основном группы C и D), стафилококки, молочнокислые палочки. Могут встречаться аэробные бактерии и грибы. Общее содержание бактерий достигает 105 в 1 мл кишечного содержимого.
В полости дистального отдела подвздошной кишки количество микробов достигает уже 107–108 на 1 мл. В 1 г фекалий толстой кишки – 1011 на 1 г. Микробный пейзаж здесь представлен кишечной палочкой, энтерококками, бактероидами и анаэробными бактериями.
Таким образом, совершенно очевидно, что при лабораторном микробиологическом исследовании фекалий мы, определяя из более чем 500 видов микроорганизмов только 10–15, иногда 20 видов, которые характеризуют в основном состояние биоценоза содержимого толстой кишки, получаем весьма ориентировочное представление об истинной картине микробиоценоза кишечника в целом.
Не случайно многочисленные классификации кишечного дисбактериоза, предложенные различными авторами на протяжении последних 50 лет (Р.В.Эпштейн-Литвак, Ф.Л.Вильшанская, 1967; А.Ф.Билибин, 1970; В.Н.Красноголовец, 1986; и др.) так и не нашли всеобщего признания. Большинство из них выделяло так называемую компенсированную форму кишечного дисбактериоза (дисбактериоз I–II степени), которая не имела клинического эквивалента.
Она могла быть случайной находкой или могла отражать обратимые транзиторные изменения микробиоценоза, не требующие медицинского вмешательства.
В некоторых случаях, если причина, обусловливающая нарушения со стороны микрофлоры кишечника, не устраняется, например при функциональных запорах, при непереносимости белков коровьего молока и т.д., такие изменения кишечного биоценоза длительно наблюдаются у пациента и создают иллюзию самостоятельной болезни.
Выраженные нарушения микробиоценоза кишечника (“декомпенсированный дисбактериоз”, “дисбактериоз III–IV степени”, по различным классификациям) могут приводить к появлению клинической картины кишечной дисфункции, чаще обусловленной секреторной диареей.
Но важно, что при этом выраженные явления кишечного дисбактериоза создают предпосылки для развития хронического инфекционно-воспалительного процесса в слизистой оболочке кишечника и повышают проницаемость кишечного барьера по отношению к инфекционным и неинфекционным антигенам, способствуя формированию пищевой аллергии.
Таким образом, более чем 80-летний период времени изучения роли кишечной микрофлоры для человеческого организма и изучения последствий ее изменения убедил врачей и исследователей в огромной значимости нормального кишечного микробиоценоза для нормальной жизнедеятельности человека.
Однако и по сей день многие стороны взаимоотношений человеческого организма и микроэкологии кишечника остаются не до конца изученными и даже спорными. Так, в период широкого внедрения антибиотикотерапии в практику здравоохранения (70–80-е годы) дисбактериоз стал диагностироваться несравненно значительно чаще, чем прежде, и завоевал себе прочное место как в сознании и практической деятельности врачей, так и в сознании широких слоев населения.
В нашей стране он даже стал самостоятельным клиническим диагнозом, причем весьма популярным. Хотя совершенно очевидно, что по своей природе кишечный дисбактериоз – это вторичное явление, отражающее функциональное состояние ЖКТ и билиарного тракта в процессе взаимодействия с окружающей средой и взаимодействии с другими проблемами организма, и поэтому он не может рассматриваться как болезнь.
Но в то же время дисбактериоз может приводить к развитию заболевания, в частности к инфекционно-воспалительному поражению различных отделов кишечника, или поддерживать и усугублять патологические изменения в ЖКТ. Поэтому отбрасывать его как несущественное явление неправильно.
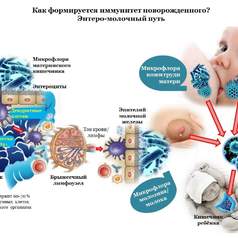
Особенно сложна трактовка микробиологических находок в раннем детском возрасте. Микробиоценоз кишечника претерпевает в первые дни и недели жизни существенные изменения. Причем, существует устойчивое мнение, что эти изменения наблюдаются только на протяжении первого месяца жизни ребенка. Так, А.М.Запруднов и Л.Н.Мазанкова [8] выделяют 3 фазы микробного заселения кишечника ребенка в первый месяц после рождения: 1-я фаза, асептическая, продолжается 10–20 ч, 2-я фаза – фаза заселения – продолжается до 2–4 дней и 3-я фаза представляет собой период стабилизации микрофлоры.
При этом авторы подчеркивают, что продолжительность первых двух фаз варьирует и зависит от множества факторов, в частности состояния здоровья новорожденного, времени условий первого прикладывания к груди и т.д.
Анализ клинического материала позволил нам выделить 2 основные группы факторов, оказывающих непосредственное влияние на становление кишечного микробиоценоза не только в неонатальном периоде жизни, но и в последующем: социально-бытовые и медицинские.
К социально-бытовым факторам относятся:
- Изменение состояния здоровья матери и ее питания.
- Использование матерью экологически загрязненных продуктов питания и воды.
- Снижение частоты грудного вскармливания.
- Использование различных смесей для вскармливания детей (сухих, жидких, обогащенных пробиотиками, среднецепочечными жирными кислотами, олигонуклеидами и т.д.).
- Совместное или раздельное пребывание матери и ребенка в родильном доме и стационаре.
- Увеличение доли недоношенных новорожденных в популяции, в том числе увеличение числа детей с экстремально низкой массой тела.
К медицинским факторам можно отнести:
- Превентивное использование антибиотиков в родильных домах детям группы риска.
- Проведение различных лечебных манипуляций довольно большому числу родившихся детей, включая введение желудочного зонда и проведение парентерального питания.
- Возрастающую заболеваемость новорожденных детей.
Исследования показывают, что у здоровых новорожденных детей при совместном пребывании их с матерью в родильном доме уже в первые сутки жизни в 23% случаях в меконии обнаруживаются бифидобактерии в количествах 104/г (собственные данные).
При раздельном пребывании с матерью новорожденных в родильном доме, а также у детей, родившихся больными, отмечается колонизация мекония не только бифидобактериями, но и энтерококками (67% детей первых двух суток жизни), коагулазоотрицательными стафилококками (66% детей), гемолитическими штаммами кишечной палочки (33%) и грибами рода Candida (в 1/3 случаев).
Причем в последние 2–3 года отмечается явное преобладание тотальной колонизации фекалий энтерококками.
Пролонгированные исследования характера и степени микробной колонизации фекалий, проведенные нами у 235 детей, родившихся в родильных домах Москвы, показали, что у здоровых детей на протяжении первого года жизни “идеальный” нормальный биоценоз кишечника встречается редко.
У значительного числа детей (не менее 30–40% наблюдаемых детей, а в возрасте от 1 до 3–4 мес –не менее чем у 50% клинически здоровых детей) в фекалиях наряду с типичной кишечной палочкой, бифидобактериями и лактобактериями выявлялись стафилококки (104–5/г), энтерококк (104–6/г), такие энтеробактерии, как Klebsiella, Proteus (102–4/г), грибы рода Candida.
С микробиологических позиций полученные нами данные свидетельствуют о наличии кишечного дисбактериоза I–II степени у половины наблюдаемых здоровых грудных детей и дисбактериоза III–IV степени – у 1/5–1/4 детей, причем дисбиотические изменения в микрофлоре фекалий преобладали в возрасте от 1 до 6 месяцев. Во втором полугодии жизни лишь у 10–15% детей можно было выявить подобные изменения.
Характерно, что, несмотря на обнаруженные отклонения микробного состава фекалий, это были нормально развивающиеся дети. Средняя прибавка массы на протяжении первого года жизни составила 610 г (в первом триместре – 820 г, во втором – 790 г, в третьем и четвертом – в среднем 420 и 400 г).
Лишь у четверти наблюдаемых детей (24%) периодически отмечались кратковременные эпизоды послабления стула, которые не сопровождались отчетливым нарушением общего состояния. Микробиологические исследования, проведенные прицельно во время этих эпизодов, выявляли увеличение концентрации 1 или 2 видов условно-патогенной аэробной микрофлоры (до 109/г), снижение содержания молочнокислых бацилл при сохранении на нормальном или субнормальном уровне степени колонизации фекалий бифидобактериями.
Известно то огромное влияние, которое оказывает на становление нормального кишечного микробиоценоза грудное вскармливание. Сопоставление микробиологических находок с характером вскармливания детей показало, что, несмотря на то, что практически все дети прикладывались к груди в родильном доме, к возрасту 2 нед только 60% получали преимущественно грудное вскармливание, 30% получали докорм смесями, а 10% были полностью переведены на искусственное вскармливание.
К месячному возрасту грудное вскармливание получали 46% детей, смешанное – 34%, искусственное – 20%. К 3-месячному возрасту лишь 5% наблюдаемых детей находились на грудном вскармливании, 35% получали смешанное вскармливание, а искусственное вскармливание составляло 60%. К 6 мес частота грудного вскармливания сократилась до 3%, уменьшилась и частота смешанного вскармливания, 4/5 детей полностью были переведены на искусственное вскармливание.
Таким образом, проведенные исследования показали, что период становления кишечного биоценоза не ограничивается только неонатальным периодом жизни ребенка. У 85–90% детей он продолжается на протяжении всего первого года жизни, а у 10–15%, по-видимому, охватывает еще больший по продолжительности период жизни.
Но и в том, и в другом случае первое полугодие жизни является наиболее ответственным и напряженным периодом становления кишечного микробиоценоза, и именно в этот период издавна стремились максимально обеспечить ребенка грудным молоком – естественным и единственным физиологическим для него видом вскармливания.
К сожалению, в настоящее время столь важный стабилизационный фактор имеет весьма ограниченное значение. Возможно, в этом заключена одна из ведущих причин столь явного кишечного дисбиоза у детей первого года жизни.
Другой, не менее важной причиной является высокая частота малых дисфункций ЖКТ у детей первого полугодия жизни, обусловленная ферментативной (в основном лактазной) недостаточностью и незрелостью вегетативной нервной системы, регулирующей моторику кишечника.
К ним относятся синдром рвоты и срыгивания, синдром функциональных запоров и синдром кишечной колики. Кстати, дисфункции ЖКТ – проблема детей в возрасте от 1 до 4–6 мес жизни [10]. Выявление подобных симптомокомплексов в более старшем возрасте обычно свидетельствует в пользу наличия у ребенка органического поражения ЖКТ (врожденные пороки развития и т.п.).
Итак, фаза стабилизации микробиоценоза кишечника у подавляющего большинства детей грудного возраста растягивается на несколько месяцев. В связи с этим встает вопрос о целесообразности и необходимости коррекции микробиологических изменений, нередко обнаруживаемых при обследовании грудных детей.
В настоящее время, когда медицинская практика располагает большим арсеналом препаратов и пищевых добавок с пробиотическим и пребиотическим действием, это далеко не праздный вопрос. Не секрет, что диагноз “дисбактериоз” является “расхожим” диагнозом, оправдывающим длительное, нередко малооправданное и малоэффективное назначение пробиотиков.
Рассматривая показания к коррекции нарушений кишечного микробиоценоза у детей грудного возраста, хотелось бы еще раз сконцентрировать внимание на основных положениях этой статьи.
Первое и основное: кишечный дисбактериоз практически никогда не бывает самостоятельно возникшим состоянием. Поэтому его коррекция требует прежде всего выявления и устранения вызвавшего его фактора. В противном случае терапия пробиотиками будет по крайней мере малоэффективна, а в ряде случаев бессмысленна.
При выявлении причин, вызывающих и поддерживающих кишечный дисбактериоз у грудных детей, особое внимание следует уделить выявлению функциональных нарушений деятельности ЖКТ, таких как синдром срыгивания и рвоты, функциональные запоры, кишечная колика.
Второе место по значимости занимают ферментопатии и прежде всего лактазная недостаточность. По данным различных авторов, от 10 до 75% населения России в зависимости от национальности имеет признаки пищевой непереносимости, обусловленной частичным или полным отсутствием фермента лактазы в тонком кишечнике [9, 10].
Дефицит лактазы может быть как врожденного (наследственная алактазия, гиполактазия), так и приобретенного, вторичного характера (вторичная лактазная недостаточность), например на фоне или в результате перенесенного энтероколита. Вторичная лактазная недостаточность встречается значительно чаще, чем наследственная энзимопатия и клинически протекает намного легче.
Клинически для лактазной недостаточности и алактазии характерны следующие проявления: стойкая длительная, но умеренно выраженная диарея или длительная неустойчивость стула (при алактазии и гиполактазии – с рождения, при вторичной лактазной недостаточности – после перенесенного энтероколита), выраженный метеоризм, повторные приступы так называемых инфантильных (младенческих) кишечных колик, срыгивания, а в более позднем возрасте – рвота.
При алактазии и гиполактазии характерно отставание от нормальных темпов прибавки массы тела. При вторичной лактазной недостаточности прибавка массы тела обычно не отличается или незначительно отличается от нормы.
В анамнезе таких пациентов, как правило, удается выявить связь между появлением желудочно-кишечной дисфункции с перенесенным острым кишечным заболеванием (при вторичной лактазной недостаточности) или указания на непереносимость молочных продуктов другими членами семьи (при наследственной энзимопатии).
Кишечный дисбактериоз является одним из обязательных патогенетических звеньев пищевой аллергии и воспалительных заболеваний кишечника, в том числе и антибиотикоассоциированной диареи.
У детей первых 6 мес жизни обнаружение микробиологических изменений в биоценозе фекалий при отсутствии клинических симптомов кишечной дисфункции, при наличии стабильной прибавки массы тела, удовлетворительном аппетите и нормальном состоянии ребенка не является основанием к назначению лечения, так как эти отклонения, скорее всего, являются вариантом нормы.
Но очень важно создать наиболее благоприятные условия для формирования нормального биоценоза. Это прежде всего всемерная поддержка грудного вскармливания, рациональное введение прикормов, а при отсутствии у матери грудного молока – оптимальный выбор заменителей женского молока.
В частности, у детей, имеющих риск развития кишечного дисбактериоза, с профилактической целью рекомендуется шире использовать кисломолочные смеси. Их доля в суточном рационе может быть увеличена до 1/2–2/3 всего объема. Из пресных смесей лучше использовать смеси с пребиотическим эффектом, т.е. смеси на сывороточной, а не на казеиновой основе, низколактозные смеси.
К ним относятся: “Омнео нутрилон” (“Нутриция”), “Нутрилон низколактозный” (“Нутриция”). Смеси “АЛ-110” (“Нестле”), “Мамекс безлактозный” (“International nutrition”, Дания), относящиеся к безлактозным смесям, также могут быть использованы в питании таких детей.
Показано также использование смесей, обогащенных пробиотиками. В настоящее время имеется довольно широкий выбор этих продуктов питания. Среди отечественных кисломолочных смесей можно назвать “Агушу”, “Бифилин”, “Бифидолакт”, “Биокефир” (последний – для детей старше 7 мес). Они обогащены штаммами лактобактерий (“Агуша”) и бифидобактерий (“Бифилин”, “Бифидолакт”), кефирным грибом. В отличие от них смесь “Лактофидус” (“Данон”) обогащена лакто- и бифидобактериями, НАН кисломолочный и НАН 6–12 – бифидобактериями и симбионтными энтерококками.
Хотелось бы подчеркнуть, что выявление у ребенка лактазной недостаточности не является поводом для ограничения, а тем более исключения грудного вскармливания. В таких случаях рекомендуется сочетание грудного вскармливания с назначением фермента лактазы, который представлен на российском рынке пищевыми ферментативными добавками, – лактраза, лактаза, тилактаза, лакт-аида, керулак, лактейк, максилак и др.
Доза пищевой добавки подбирается индивидуально в зависимости от потребностей ребенка и может колебаться от 1/5 до 1/2 капсулы на прием и от 1 до 4 капсул в сутки. Препарат дается внутрь при каждом кормлении непосредственно перед кормлением или с первыми глотками молока.
Показаниями к целенаправленной терапии кишечного дисбактериоза являются сохранение секреторной диареи или запоров при устранении причин, их обусловивших, наличие антибиотикоассоциированной диареи, кишечного дисбактериоза, поддерживающего и/или отягощающего течение основного заболевания (например, пищевой аллергии, порока развития ЖКТ, ферментопатии и т.д.).
Обычно лечение включает следующие направления [2]:
- снижение избыточного микробного обсеменения тонкой кишки,
- восстановление нормальной микрофлоры,
- улучшение кишечного пищеварения,
- восстановление нормальной моторики кишечника.
Для снижения микробного обсеменения тонкой кишки во взрослой практике принято использование антибиотиков и других антисептиков (нитрофуранов, налидиксовой кислоты). Но у детей раннего возраста при отсутствии клинически и лабораторно очерченных признаков энтероколита предпочтительно использование не антибиотиков, а препаратов, относящихся к группе пробиотиков.
Это прежде всего споровые монокомпонентные пробиотики – бактисубтил, флонивин БС, бактиспорин, бактисубтил, – и для детей старше 2 лет – монокомпонентный пробиотик, содержащий дрожжевые грибы, – энтерол. Длительность терапии этими препаратами обычно составляет 7–10 дней.
На втором этапе терапии основное внимание уделяется восстановлению нормальной микрофлоры. С этой целью используются как широко известные монокомпонентные (бифидумбактерин, лактобактерин, витанар), так и поликомпонентные (примадофилюс, флорадофилюс) и комбинированные пробиотики. В некоторые поливалентные препараты наряду со штаммами бифидо- и лактобактерий включены штаммы энтерококков, обладающих высокой антагонистической активностью по отношению к условно-патогенным и патогенным возбудителям (“Линекс”, “Бифиформ”).
Это значительно повышает активность препаратов по сравнению с монокомпонентными пробиотиками и такими поликомпонентными препаратами, как “Примадофилюс” и “Флорадофилюс”.
Комбинированные препараты (“Бифиформ”, “Аципол”, “Гиалакт”) содержат также добавки, стимулирующие рост нормальной микрофлоры: лизоцим (“Аципол”), лактулозу (“Бифиформ”), экстракт рожкового дерева, нормализующий моторику кишечника (“Бифиформ”), гиалуроновую кислоту, обладающую противовоспалительным действием (“Гиалакт”).
Монокомпонентные пробиотики желательно сочетать с препаратом “Хилак форте”, который обладает пребиотическим эффектом. Общая длительность второго этапа терапии дисбактериоза должна составлять не менее 3 нед.
К сожалению, в настоящее время мы не располагаем серьезными рандомизированными исследованиями, позволяющими достоверно оценить эффективность различных препаратов и схем терапии кишечного дисбактериоза в детском возрасте.
Поэтому эффективность лечения во многом зависит от правильности оценки клинической ситуации, адекватного лечения основного заболевания и вскармливания ребенка и рационального выбора препаратов.
Литература
1. Красноголовец В.Н. Дисбактериоз кишечника. М.: Медицина, 1989; 16–36.
2. Парфенов А.И., Осипов Г.А., Богомолов П.О. Дисбактериоз кишечника: новые подходы к диагностике и лечению. Consilium medicum 2001; 3 (6): 270–9.
3. Nisstle A. Erlanterungen uber die Bedeutung der Kolondys bakterie und den Werkungsmechanismus der Coliterapie (Mutaflor). Medizinescht, 1959; 21: 1017–22.
4. Перетц Л.Г. Значение нормальной микрофлоры для организма человека. М.: Медгиз, 1955; 436 с.
5. Перетц Л.Г. Микрофлора человеческого тела. Руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. М., 1962; 1: 659–571.
6. Шендеров Б.А. Медицинская микробная экология и функциональное питание. Микрофлора человека и животных. М.: Грантъ, 1998; 1: 288 с.
7. Шендеров Б.А. Социально-экологические и клинические последствия дисбаланса микробной экологии человека и животных. Микрофлора человека и животных. М.: Грантъ. 1998; 2: 416 с.
8. Запруднов А,М., Мазанкова Л.Н. Микробная флора кишечника и пробиотики. Приложение к журналу “Педиатрия”. М., 1999; 48 с.
9. Бельмер С.В. Лактазная недостаточность. Русский медицинский сервер. . Дет. гастроэнтеролог. 2000.
10. Коровина Н.А., Захарова И.Н., Малова Н.Е. Лактазная недостаточность у детей. Вопросы современной педиатрии 2002; 1 (4): 57–61.