В последнее время стало очевидным, что качество окружающей среды в значительной мере определяет уровень здоровья населения. Это относится к широкому спектру факторов среды как естественного, так и техногенного происхождения и связано в первую очередь с большим объемом поступления в окружающую среду (при низком уровне контроля) промышленных, сельскохозяйственных, бытовых и прочих отходов.
Как показывают эпидемиологические исследования, даже при невысоких уровнях этих воздействий в организме ребенка могут развиваться негативные изменения.
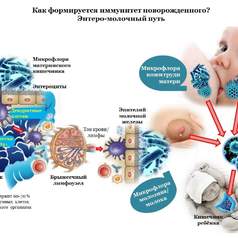
Комплекс проблем экологического характера приводит к ухудшению состояния экологии внутренней среды ребенка и прежде всего состояния нормальной микрофлоры. Эволюционно сформированные в процессе естественного отбора симбиотические взаимоотношения человека и микроорганизмов в различных экологических нишах постоянно подвергаются разрушающему воздействию, особенно под давлением широкомасштабного (часто необоснованного) применения антибактериальных средств.
Дисбаланс эволюционно сложившейся экологической системы организма человека с представителями микромира, возникающий при этом, несет для человека тяжелейшие последствия и изменяет функционирование систем гомеостаза. Нормофлора ребенка в этой ситуации становится зеркалом, отражающим состояние внутренних органов, индикатором явной и скрытой патологии.
Не будет преувеличением сказать, что мы живем в эру антибиотиков (АБ). Широкое применение АБ в животноводстве и ветеринарии привело в последние годы к тому, что стала отмечаться высокая степень “ загрязнения” пищевых продуктов АБ. Так, тетрациклиновые АБ обнаруживают в 11% мяса и мясных продуктов, пенициллин – в 33%, стрептомицин – в 25% образцов молока (В.М.Бондаренко, Н.М.Грачева, 2003).
АБ для местного и системного применения занимают первые места в общем объеме продаж, антибиотикотерапия является ведущей в практике любого врача, так как позволяет таким образом добиваться решающего успеха в лечении большинства инфекционных заболеваний. Однако их неоправданное применение и, к сожалению, уже ставшее привычным в нашей стране, например при острых респираторных заболеваниях (ОРВИ) у детей, чревато серьезными последствиями.
Та же тенденция характерна и для других стран. В литературе приводятся данные об использовании АБ при ОРВИ у детей в 14–80% случаев. По данным В.К.Таточенко (2004 г.), АБ при не осложненных ОРВИ применяют во Франции в 24% случаев, США – в 25%, Канаде – в 38%, в Дании у 60% детей до 2 лет получают минимум один курс АБ, а в Китае – 97% детей, обратившихся за медицинской помощью.
Повсеместная озабоченность излишним назначением АБ связана и с рядом конкретных опасностей, а именно – непрекращающимся процессом формирования антибиотикоустойчивых штаммов микроорганизмов, а также развитие нежелательных и побочных эффектов антибактериальной терапии (аллергизация организма, изменение направленности иммунного ответа, токсическое действие, развитие дисбактериозов и др.), предъявляют к врачам высокие требования в плане составления рациональной схемы предстоящего лечения инфекционного заболевания.
Особое место среди осложнений антибиотикотерапии занимают антибиотико-ассоциированные диареи (ААД). Согласно общепринятому определению ААД – это три эпизода неоформленного стула и более, развившихся на фоне применения антибактериальных препаратов вплоть до 4–8 нед после их отмены, если не выявлена другая причина.
Спектр клинической манифестации ААД – от легкой самокупирующейся диареи до тяжелого псевдомембранозного колита. Одним из первых вопросов, на который врачу приходится искать ответ в этой ситуации: связана ли диарея с самой инфекцией, или это проявление каких-либо других, нежелательных эффектов антимикробного препарата?
Всю совокупность причин АДД можно объединить в следующие группы:
- аллергические, токсические и фармакологические побочные эффекты собственно антибиотиков;
- осмотическая диарея в результате нарушения метаболизма желчных кислот и углеводов в тонкой кишке;
- избыточный микробный рост в результате подавления облигатной интестинальной микрофлоры.
Наблюдения различных авторов свидетельствуют, что диарея развивается у 5–30% лиц, получающих антибиотикотерапию. Неинфекционные причины, которые, как правило, отождествляются многими авторами с основным действием антибиотиков, встречаются довольно часто. Например, стимуляция моторики желудочно-кишечного тракта, вызванная мотилиноподобным действием 14-членных макролидов.
Практически все они (особенно эритромицин) вызывают диарею. Послабляющее действие может быть обусловлено также наличием в препарате дополнительного компонента, например клавулановой кислоты. Аналогичным действием обладают парентеральные цефалоспорины, выделяющиеся с желчью (цефоперазон и цефтриаксон) и пероральный цефалоспорин цефиксим.
Кроме того, некоторые антибиотики (хлорамфеникол, тетрациклин) оказывают прямое токсическое действие на слизистую оболочку кишечника. Иногда применение антибактериальных препаратов ведет к скрытой индукции мальабсорбции.
Еще одним из механизмов формирования диарейного синдрома на фоне приема АБ является грубые нарушения состава нормальной микрофлоры кишечника. В частности установлено, что ампициллин в значительной степени подавляет рост как аэробной, так и анаэробной микрофлоры, тогда как амоксициллин, в меньшей степени подавляя активность большинства нормальных кишечных микроорганизмов, способствует росту популяции представителей рода Enterobacteriacaea.
Подобным образом на микробиоценоз кишечника влияет и комбинированный препарат амоксициллина и клавулановой кислоты. При этом большинство современных пенициллинов не способствуют размножению грибов и С. difficile. Пероральные цефподоксим, цефпрозил и цефтибутен стимулируют рост Enterobacteriacaea в кишечнике, тогда как цефаклор и цефрадин практически не оказывают влияния на кишечную микрофлору, а применение цефиксима ведет к значительному снижению анаэробных микроорганизмов.
Важно отметить, что большинство цефалоспоринов способствует росту численности энтерококков и С. difficile. При этом способ введения антибиотика не играет значения. При пероральном приеме АБ помимо влияния на кишечную микрофлору происходит местное воздействие их непосредственно на слизистую оболочку кишки; при парентеральном введении АБ воздействуют на микробиоценоз кишечника, выделяясь со слюной, желчью, секретами тонкой и толстой кишок.
Из инфекционных причинно-значимых агентов ААД диареи наиболее серьезным и опасным является Clostridium difficile. По данным зарубежных авторов, диарея, обусловленная Clostridium difficile, составляет 30% всех антибиотик-ассоциированных диарей, 50–75% антибиотикассоциированных колитов.
Практически все случаи псевдомембранозного колита обусловлены данным микроорганизмом. Носительство С. difficile в популяции здорового населения составляет не более 3%. Частота обнаружения данного микрорганизма возрастает до 20% у пациентов, получающих антибиотики.
Как показали данные L.McFarlanda, это связано с экзозенным инфицированием пациентов, а не с активацией микроба при асимптоматическом носительстве бактерий. Наиболее высокий показатель выявления клостридий данного вида регистрируется у новорожденных, хотя и протекает без клинической манифестации, что по всей видимости обусловлено отсутствием у них на слизистой оболочке желудочно-кишечного тракта (ЖКТ) рецепторов к токсинам возбудителей.
У 15–35% пациентов после первого эпизода С. difficile-ассоциированной диареи наблюдаются рецидивы инфекции, которые связаны с длительным персистированием в кишечнике спор возбудителя или реинфекцией новым штаммом. Исследования последних лет показывают, что восприимчивость к этой инфекции в значительной мере определяется характером иммунного ответа макроорганизма на токсины, продуцируемые С. difficile.
На сегодняшний день установлено, что ААД вызывают только токсигенные штаммы С. difficile. При этом ключевым моментом запуска патогенного потенциала данного микроорганизма является нарушение состава эндогенной микрофлоры, сопровождающееся снижением колонизационной резистентности. Только в этих условиях Cl. difficile способна колонизировать слизистую оболочку толстой кишки.
Токсины А и В, продуцируемые токсинобразующими штаммами клостридий, значительно нарушают процессы всасывания воды, повреждают стенку кишки, вызывая воспаление, и как следствие возникает диарея, а также серьезные нарушения электролитного баланса. Примерно у половины больных с ААД заболевание прогрессирует и развивается довольно тяжелое состояние, сопровождающееся глубоким повреждением кишечной стенки – псевдомембранозный колит (ПМК).
Причиной ААД, вероятно, могут быть и другие микробы, в частности метициллин-резистентные штаммы S. aureus, способные продуцировать энтеротоксин. Длительное время вызывала споры роль грибов рода Сandida в развитии ААД. Данные ряда исследований, проведенных в последние годы, показали, что нет достаточного количества доказательных данных, свидетельствующих о том, что грибы рода Candida способны вызывать ААД у взрослых.
Было показано, что частота выделения грибов рода Candida в стуле и количество грибковых клеток у пациентов с антибиотик-ассоциированной диареей не отличаются от данных показателей у пациентов с симптомами диареи, которые также принимали антибиотики. Избыточный рост грибов у пациентов с диареей, которые не принимали антибактериальные препараты, встречался реже, чем у пациентов с ААД, однако частота выделения кандид была одинакова в обеих группах.
Кроме того, было сделано предположение о том, что снижение числа энтеробактерий в стуле, вызванное приемом антибиотиков и увеличением жидкого объема стула при диарее, приводит к увеличению числа грибов рода Candida. В качестве гипотезы было отмечено, что грибковые токсины и токсиноподобные вещества (аспартил протеиназа – Saps и фосфолипазы) могут быть ответственны за развитие ААД.
Однако было обнаружено, что их содержание не отличается между исследуемыми группами пациентов. Кроме того, продукция фосфолипаз штаммами кандид, выделенных из стула пациентов с ААД, не отличалась от таковой в контрольной группе. В связи с этим можно сделать вывод, что основные факторы вирулентности грибов рода Candida – Saps и фосфолипазы – не связаны с развитием антибиотик-ассоциированной диареи у взрослых.
Одной из нерешенных проблем современной медицины остается диагностика С. difficile-ассоциированной диареи. По мнению В.А.Малова (2002 г.), об ААД, обусловленной С. difficile, следует думать при появлении диареи у пациентов, получавших антибиотики в течение предшествующих 2 мес, либо если диарея появилась через 3 дня после начала антибактериальной терапии.
Определяющим в постановке диагноза является обнаружение токсигенных штаммов микроорганизма. “Золотым” стандартом для их идентификации является исследование цитопатического эффекта на культуре клеток. Это наиболее чувствительный метод диагностики, однако в силу сложной технологии он доступен немногим лабораториям.
Наиболее широко используется в клинической практике иммуноферментный анализ, позволяющий обнаруживать как токсин А, так и токсин В. По чувствительности данный метод несколько уступает цитотоксическому методу (дает до 10–20% ложноотрицательных результатов). Однако важным аргументом выступает доступность для врача результатов исследования уже через 2–3 ч.
Высокая частота развития диарейного синдрома у пациентов, получающих антибиотики, обусловливает поиск методов профилактики ААД. Важным моментом является проведение четкого и взвешенного выбора антибактериальных препаратов, с учетом факторов риска. Например, широкое применение линкомицина в амбулаторной практике не оправдано ни с микробиологической, ни с клинической точки зрения.
Это резервный препарат (плохо, что стали забывать об этом понятии). Риск развития псевдомембранозного колита при применении линкомицина или клиндамицина в 70 раз выше, чем при использовании амоксициллина. Высокий риск развития антибиотик-ассоциированной диареи сопряжен также с применением оральных цефалоспоринов.
Одним из перспективных направлений профилактики ААД является использование эубиотиков – пре- и пробиотиков. T. Lyons и R. Fallon недаром назвали наше время “ наступающей эпохой пробиотиков”, и действительно, бурное развитие исследований по разработке новых пробиотиков и дальнейшему изучению их лечебно-профилактического действия дает основание утверждать, что в XXI веке пробиотики потеснят на рынке традиционные и небезопасные для организма препараты, особенно те из них, которые применяются с профилактической целью.
Пробиотики – это живые микроорганизмы и вещества микробного происхождения, оказывающие при естественном способе введения позитивные эффекты на физиологические, биохимические и иммунные реакции организма хозяина через стабилизацию и оптимизацию функции его нормальной микрофлоры.
Недавно опубликовано несколько обзоров клинических исследований по эффективности живых пробиотических микроорганизмов при лечении и профилактике ААД. Авторы подчеркивают, что препараты, содержащие S. boulardii, традиционно рекомендуемые для профилактики ААД, предотвращают развитие нежелательных явлений, связанных с назначением АБ.
Ряд работ на животных и людях позволил предположить, что S. boulardii препятствует реализации эффектов токсинов, продуцируемых С. difficile, путем их ферментативного расщепления с помощью сериновой протеазы. У пациентов с рецидивирующим течением С. difficile-ассоциированной диареи, получавших традиционную антибактериальную терапию (ванкомицин и/или метронидазол) в сочетании с культурой S. boulardii, отмечена более низкая частота рецидивов (26%) по сравнению с таковой у пациентов, получавших только АБ (45%).
В то же время не выявлено преимуществ использования S. boulardii у пациентов с первым эпизодом инфекции С. difficile. Принимая во внимание изложенные данные, объективности ради, следует заметить, что требуются дополнительные хорошо организованные исследования для выяснения конкретных механизмов действия и истинного клинического значения этих препаратов.
Проведен ряд клинических исследований, демонстрирующих возможности использования штамма Lactobacillus GG для профилактики ААД у детей, получавших различные антимикробные препараты. Так, в рандомизированном исследовании (с двойным слепым контролем и плацебо-контролем) острые инфекции у 188 детей лечили, используя часто применяемые АБ. Половина пациентов получала по 1–2 капсулы с Lactobacillus GG (1ґ1010 КОЕ/мл) 1 раз в день, вторая половина пациентов получала идентичные капсулы с плацебо, не содержавшие пробиотических бактерий (1 капсулу давали детям с массой тела менее 12 кг, 2 капсулы – детям с массой тела более 12 кг).
Мониторинг желудочно-кишечной симптоматики проводили с помощью опросов по телефону. В группе, получавшей помимо АБ Lactobacillus GG, отмечено достоверно меньшее количество эпизодов и выраженность диареи, чем в группе сравнения.
В другом исследовании у детей, получавших антибактериальную терапию по поводу острых инфекций, частота эпизодов диареи в группе, получавшей пробиотик L. GG, составила 8%, а в группе плацебо – 26%.
В то же время в рандомизированном двойном слепом плацебо-контролируемом исследовании у госпитализированных взрослых пациентов не продемонстрировало преимуществ использования штамма Lactobacillus GG с точки зрения его влияния на частоту развития острой диареи. Так, диарея развилась у 29% пациентов, получавших Lactobacillus GG, и у 30% в группе плацебо. Различий в частоте диареи у пациентов, получавших b-лактамы, и у леченных АБ других групп не выявлено.
Определенные надежды связывают и с рядом других пробиотиков, в частности, ежедневный прием 1,5ґ108 КОЕ Enterococcus SF68 в течение 7 дней сократил число новых случаев диареи, вызванной приемом антибиотиков. Диарея развилась у 2 из 23 больных, получавших Enterococcus SF68, в то время как в группе принимавших плацебо – у 6 из 22 больных.
В последние годы в клиническую практику внедрены принципиально новые препараты для коррекции микрофлоры кишечника, созданные на основе набора микробных метаболитов, в частности летучих жирных кислот, получившие по новой классификации название пробиотиков метаболитного типа.
Такие препараты, воздействуя непосредственно на метаболическую активность микроорганизмов биопленок слизистых оболочек, способны оказывать положительное влияние на физиологические функции и биохимические реакции организма человека. К числу пробиотиков метаболитного типа относится хилак форте.
Эффект позитивного действия хилака форте определяется комплексом составляющих препарат бактерийных метаболитов и оригинальных добавок, характеризующихся спектром индивидуальных регуляторных функций, что позволяет использовать его как профилактическое и терапевтическое средство при ряде заболеваний ЖКТ с явлениями дисбактериоза.
Основные механизмы позитивного действия хилака форте при ААД окончательно не установлены, так как они опосредуются целым комплексом разнообразных взаимосвязанных эффектов, включающих нормализацию процессов электролитного обмена и окислительного фосфорилирования, синтеза витаминов В и К, восстановлением нарушенных функций иммунологических реакций, что придает дополнительную сложность оценки его воздействия на организм.
Использование хилак форте совместно с АБ обеспечивает поддержание оптимального уровня рН в просвете кишки, что повышает колонизационную резистентность, препятствует росту условно патогенной микрофлоры, а также способствует быстрому восстановлению микроэкологического статуса, что открывает несомненные перспективы использования препарата для лечения и профилактики ААД у детей и взрослых.